
题目列表(包括答案和解析)
(15分)某研究小组对一元有机弱酸HA在溶剂苯和水的混合体系中溶解程度进行研究。在25℃时,弱酸HA在水中部分电离,HA的电离度为0.10;在苯中部分发生双聚,生成(HA)2。该平衡体系中,一元有机弱酸HA在溶剂苯(B)和水(W)中的分配系数为K,K=C(HA)B/C(HA)W=1.0,即达到平衡后,以分子形式存在的HA在苯和水两种溶剂中的比例为1∶1;已知:lg2=0.3,lg3=0.5 其他信息如下:
|
25℃平衡体系(苯、水、HA) |
平衡常数 |
焓变 |
起始总浓度 |
|
在水中,HA === H++A- |
K1 |
△H1 |
3.0×10-3 mol·L-1 |
|
在苯中,2HA == (HA)2 |
K2 |
△H2 |
4.0×10-3 mol·L-1 |
回答下列问题:
(1)计算25℃时水溶液中HA的电离平衡常数K1= 。
(2)25℃,该水溶液的pH为 ,在苯体系中HA的转化率为__________。
(3)25℃混合体系中,HA在苯中发生二聚,若测得某时刻溶液中微粒浓度满足 ,则反应向_______方向进行。
,则反应向_______方向进行。
(4)在苯中,HA自发进行发生二聚:2HA (HA)2, 已知该二聚反应的反应热数值约为活化能的5/9 。下列能量关系图最合理的是
。
(HA)2, 已知该二聚反应的反应热数值约为活化能的5/9 。下列能量关系图最合理的是
。

(5)下列有关该混合体系说法不正确的是 。
A.用分液漏斗分离得到水溶液和苯溶液,若水溶液中加入少量水,苯溶液中加少量苯,则上述平衡均正移,且c(HA)均减小。
B.升高温度,HA的电离平衡常数K1和2HA  (HA)2的平衡常数K2均变大。
(HA)2的平衡常数K2均变大。
C.若用酸碱中和滴定的分析方法,可以测出HA的起始总浓度。
D.在25℃时,若再加入一定量的HA固体,则水和苯中HA的起始总浓度之比仍为3:4。
(6)在25℃时,用0.1000mol/L氢氧化钠溶液滴定20.00mL 0.1000mol/L HA水溶液,请在下图中画出滴定曲线示意图。

(13 分)
(1)CuSO4溶液是中学化学及工农业生产中常见的一种试剂。某同学利用CuSO4溶液,进行以下实验探究。
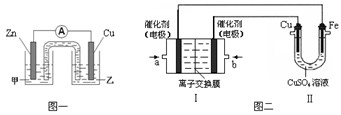
① 图一是根据反应Zn + CuSO4 = Cu + ZnSO4设计成的锌铜原电池。电解质甲溶液是 (填“ZnSO4”或“CuSO4”)溶液;Cu极的电极反应式是 。
②图二中,Ⅰ是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,该同学想在Ⅱ中实现铁上镀铜,则b处通入的是 (填“CH4”或“O2”),a处电极上发生的电极反应式是 。
(2)将蓝矾(CuSO4·5H2O)、生石灰和水按一定比例混合,即可得到波尔多液(杀菌剂),其 有效成分为难溶的碱式硫酸铜[xCuSO4·yCu(OH)2]。为测定某碱式硫酸铜的组成进行了如下实验:取等质量的碱式硫酸铜样品两份,一份滴加稀盐酸至恰好完全溶解,另一份高温灼烧后只得到CuO固体。所得数据显示n(HCl)︰n(CuO)=3︰2,则该碱式硫酸铜的化学式中x︰y= 。
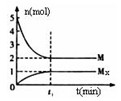
(3)E是非金属性最强的元素,M是E的气态氢化物,在固定体积的密闭容器中,气体M存在如下关系:
xM(g)![]() Mx(g),反应物和生成物的物质的量随时间的变化关系如下图。下 列说法正确的是
Mx(g),反应物和生成物的物质的量随时间的变化关系如下图。下 列说法正确的是
A.该反应的化学方程式是2HF![]() (HF)2
(HF)2
B.平衡时混合气体的平均摩尔质量是33.3
C.t1时刻,保持温度不变,再充入1molM,重新达到平衡时, 将增大
将增大
D.M的沸点比同主族下一周期元素的气态氢化物沸点低
(13 分)
(1)CuSO4溶液是中学化学及工农业生产中常见的一种试剂。某同学利用CuSO4溶液,进行以下实验探究。
① 图一是根据反应Zn + CuSO4 =" Cu" + ZnSO4设计成的锌铜原电池。电解质甲溶液是 (填“ZnSO4”或“CuSO4”)溶液;Cu极的电极反应式是 。
②图二中,Ⅰ是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,该同学想在Ⅱ中实现铁上镀铜,则b处通入的是 (填“CH4”或“O2”),a处电极上发生的电极反应式是 。
(2)将蓝矾(CuSO4·5H2O)、生石灰和水按一定比例混合,即可得到波尔多液(杀菌剂),其有效成分为难溶的碱式硫酸铜[xCuSO4 ·yCu(OH)2]。为测定某碱式硫酸铜的组成进行了如下实验:取等质量的碱式硫酸铜样品两份,一份滴加稀盐酸至恰好完全溶解,另一份高温灼烧后只得到CuO固体。所得数据显示n(HCl)︰n(CuO)=3︰2,则该碱式硫酸铜的化学式中x︰y= 。
(3)E是非金属性最强的元素,M是E的气态氢化物,在固定体积的密闭容器中,气体M存在如下关系:
xM(g) Mx(g),反应物和生成物的物质的量随时间的变化关系如下图。下 列说法正确的是
Mx(g),反应物和生成物的物质的量随时间的变化关系如下图。下 列说法正确的是 
A.该反应的化学方程式是2HF (HF)2 (HF)2 |
| B.平衡时混合气体的平均摩尔质量是33.3 |
C.t1时刻,保持温度不变,再充入1molM,重新达到平衡时, 将增大 将增大 |
| D.M的沸点比同主族下一周期元素的气态氢化物沸点低 |
(13 分)
(1)CuSO4溶液是中学化学及工农业生产中常见的一种试剂。某同学利用CuSO4溶液,进行以下实验探究。
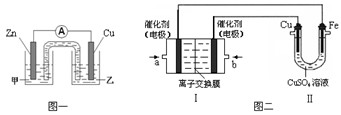
① 图一是根据反应Zn + CuSO4 = Cu + ZnSO4 设计成的锌铜原电池。电解质甲溶液是 (填“ZnSO4”或“CuSO4”)溶液;Cu极的电极反应式是 。
②图二中,Ⅰ是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,该同学想在Ⅱ中实现铁上镀铜,则b处通入的是 (填“CH4”或“O2”),a处电极上发生的电极反应式是 。
(2)将蓝矾(CuSO4·5H2O)、生石灰和水按一定比例混合,即可得到波尔多液(杀菌剂),其 有效成分为难溶的碱式硫酸铜[xCuSO4 ·yCu(OH)2]。为测定某碱式硫酸铜的组成进行了如下实验:取等质量的碱式硫酸铜样品两份,一份滴加稀盐酸至恰好完全溶解,另一份高温灼烧后只得到CuO固体。所得数据显示n(HCl)︰n(CuO)=3︰2,则该碱式硫酸铜的化学式中x︰y= 。
(3)E是非金属性最强的元素,M是E的气态氢化物,在固定体积的密闭容器中,气体M存在如下关系:
xM(g) Mx
(g),反应物和生成物的物质的量随时间的变化关系如下图。下 列说法正确的是
Mx
(g),反应物和生成物的物质的量随时间的变化关系如下图。下 列说法正确的是
B.平衡时混合气体的平均摩尔质量是33.3
C.t1时刻,保持温度不变,再充入1molM,重新达到平衡时, 将增大
将增大
D.M的沸点比同主族下一周期元素的气态氢化物沸点低
 Mx(g),反应物和生成物的物质的量随时间的变化关系如下图。下 列说法正确的是
Mx(g),反应物和生成物的物质的量随时间的变化关系如下图。下 列说法正确的是 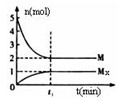
A.该反应的化学方程式是2HF (HF)2 (HF)2 |
| B.平衡时混合气体的平均摩尔质量是33.3 |
C.t1时刻,保持温度不变,再充入1molM,重新达到平衡时, 将增大 将增大 |
| D.M的沸点比同主族下一周期元素的气态氢化物沸点低 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com