
题目列表(包括答案和解析)
氨是一种重要的化工产品,是氮肥工业及制造硝酸的原料。为探究氨气的性质,某研究性学习小组做了以下实验:

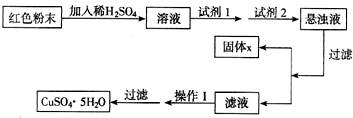
⑴ 实验室用A图所示实验装置及化学药品(其中碱石灰为固体氢氧化钠和生石灰的混合物来制取氨气。
① 实验室制取氨气的化学方程式为 。
② 若用加热碳酸氢铵固体制取纯净的氨气,你认为装置中U型管的作用是
。
⑵ 在实验中发现E装置中的固体由黑色变为红色,可推测氨气具有 性。
⑶ 某同学查阅资料发现Cu2O粉末也呈红色,因此推测上述红色固体中可能还含有Cu2O。已知:① Cu2O是碱性氧化物,在酸性溶液中Cu+不稳定,易转化为Cu和Cu2+。
② 在空气中高温灼烧时:Cu2O稳定、不分解,而CuO将分解生成Cu2O和O2。
现有浓硝酸、稀硫酸、稀硝酸、氢氧化钠溶液及pH试纸,而没有其他试剂,请用最简便的实验方法证明红色固体中是否含有Cu2O。(简述操作方法、现象和结论)
![]() ⑷ 现有一份一定质量Cu和Cu2O混合物,向其中加入0.4L 3.0mol/L稀硝酸,混合物完全溶解,同时生成4.48L NO(标准状况),向所得溶液中加入一定体积1.0mol/L NaOH溶液恰好使Cu2+沉淀完全,沉淀经洗涤、充分灼烧可得32.0g固体。下列有关说法正确的是【已知:3Cu2O + 14HNO3(稀) 6Cu(NO3)2 + 2NO↑+ 7H2O】___________
⑷ 现有一份一定质量Cu和Cu2O混合物,向其中加入0.4L 3.0mol/L稀硝酸,混合物完全溶解,同时生成4.48L NO(标准状况),向所得溶液中加入一定体积1.0mol/L NaOH溶液恰好使Cu2+沉淀完全,沉淀经洗涤、充分灼烧可得32.0g固体。下列有关说法正确的是【已知:3Cu2O + 14HNO3(稀) 6Cu(NO3)2 + 2NO↑+ 7H2O】___________
A.加入NaOH溶液的体积为1.2L
B.Cu和Cu2O混合物质量为27.2g
C.混合物完全溶解后溶液中n(H+)=0.3mol
D.将等质量混合物完全还原至少需标准状况下H21.12L
| 9(b-a) |
| a |
| 9(b-a) |
| a |
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
(1)B是用来收集实验中产生的气体的装置,但未将导管画全,请把导管补充完整。(在原图中画即可)
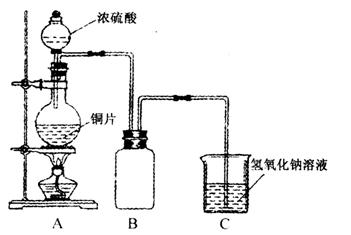
(2)实验中他们取6.4 g铜片和12 mL18 mol·1-1浓硫酸放在圆底烧瓶中加热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①请写出铜跟浓硫酸反应的化学方程式:_________________________________________。
②为什么有一定量的余酸但未能使铜片完全溶解?你认为原因是:____________________。
③下列药品中能够用来证明反应结束后的烧瓶中确有余酸的是:_________________(填写字母编号)。
A.铁粉 B.BaCl2溶液
C.银粉 D.Na2CO3溶液
(3)为定量测定余酸的物质的量浓度,甲、乙两学生进行了如下设计:①甲学生设计的方案是:先测定铜与浓硫酸反应产生SO2的量,再计算余酸的物质的量浓度,他认为测定SO2的量的方法有多种,请问下列实验方案中不可行的是______________________(填写字母编号)。
A.将装置A产生的气体缓缓通过预先称量过的盛有碱石灰的干燥管,结束反应后再次称量
B.将装置A产生的气体缓缓通入足量的用稀硫酸酸化的KMnO4溶液,再加入足量的BaCl2溶液,过滤、洗涤、干燥、称量沉淀
C.用排水法测定装置A产生气体的体积(已折算成标准状况下)
D.将装置A产生的气体缓缓通入足量的氢氧化钡溶液中,反应完全后,过滤、洗涤、干燥,称最沉淀
②乙学生没计的方案是:向反应后的溶液中加蒸馏水稀释至1000 mL,取20 mL于锥形瓶中,滴入2—3滴甲基橙指示剂,用标准氢氧化钠溶液进行滴定(已知:Cu(OH)2开始沉淀的pH约为5),通过测出消耗NaOH溶液的体积来求余酸的物质的量浓度。假定反应前后烧瓶中溶液的体积不变,你认为乙学生没计的实验方案能否求得余酸的物质的量浓度_______(填“能”或“否”),其理由是_______。
(4)请再设计一个可行的实验方案,来测定余酸的物质的量浓度,简要写出操作步骤及需要测定的数据(不必计算)________________________________________________________。
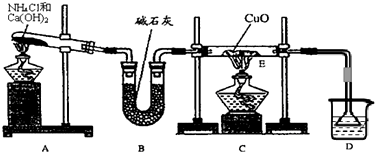
(16分)某校高三同学高考前重做以下两个课本实验,请你回答实验过程中的相关问题:
(1)铝热反应实验:取磁性氧化铁粉按课本中的实验装置(如图)进行铝热反应,将反应
后所得“铁块”溶于盐酸,向反应后的溶液中滴加KSCN溶液,发现溶液变血红色。
①出现这种现象的原因,除了因“铁块”中可能混有没反应完的
磁性氧化铁外,还有一种可能原因是 。
② 若要证明反应所得“铁块”中含有金属铝,可用 (填化学式)溶液,所发生反应的离子方程式为 。
(2)化学反应速率影响因素的探究实验:
KI在经酸化的溶液中被空气氧化的反应式为:4H+ + 4I-+ O2 = 2I2 + 2H2O。该反应的速率受温度、酸度、溶剂、试剂浓度等影响,可用淀粉与碘的显色反应来观测该反应的速率。已知,淀粉与碘的显色反应在温度升高时灵敏度会降低,高于75℃则不能显色;淀粉浓度越高显色越灵敏、颜色也越深。
实验小组拟用0.8 mol·L-1 KI溶液、0.1 mol·L-1H2SO4溶液、淀粉溶液等来探究温度、酸度对上述反应速率的影响,他们做了A—C三组实验,部分实验数据如下表:
| 编号 | 温度/℃ | H2SO4体积/mL | KI溶液体积/mL | H2O体积/mL | 淀粉溶液 / mL | 出现蓝色时间 /s |
| A | 39 | 10 | 5 | 5 | 1 | 5 |
| B | TB | 10 | 5 | 5 | 1 | 没出现蓝色 |
| C | 5 | 10 | 5 | 5 | 1 | 39 |
| D | | | | | | t |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com