
题目列表(包括答案和解析)
已知pH值为1的某溶液中,含有较多量的Ag+和Na+,则溶液中可能大量存在的离子是:
A、NO3- B、CO32- C、F- D、Cl-
已知pH值为1的某溶液中,含有较多量的Ag+和Na+,则溶液中可能大量存在的离子是:
A、NO3- B、CO32- C、F- D、Cl-
随着工业的迅速发展,产生的废水对水体的污染也日趋严重.通过控制溶液的pH对工业废水中的金属离子进行分离是实际工作中经常使用的方法.下表是常温下金属氢氧化物的K sp(沉淀溶解平衡常数)和金属离子以氢氧化物沉淀所需的pH.
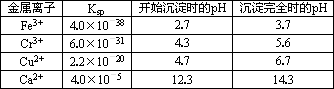
(1)某厂排出的废水中含有Cu2+和Fe3+,测得其浓度均小于0.1 mol·L-1.为除去其中的Fe3+,回收铜,需控制的pH范围是________.
(2)为了处理含有Cr2O72-酸性溶液的工业废水,采用如下方法:向废水中加人适量NaCl,以Fe为电极进行电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成排出,从而使废水中铬含量低于排放标准.
①Cr2O72-转变为Cr3+的离子方程式为________.
②pH对废水中Cr2072-去除率的影响如下图.

你认为电解过程中溶液的pH取值在________范围内对降低废水中的铬含量最有利,请说明理由:________.[注:去除率(%)=[(c0-c)/co]×100%,式中:co-处理前废水中Cr2O72-的浓度,c-处理后废水中Cr2O72-的浓度]
(3)沉淀转化在生产中也有重要应用.例如,用Na2CO3溶液可以将锅炉水垢中的CaSO4转化为较疏松而易清除的CaCO3,该沉淀转化达到平衡时,其平衡常数K=________(写数值).[已知Ksp(CaSO4)=9.1x10-6,Ksp(CaCO3)=2.8×10-9]
某同学用比色法测定标准含铁量100 mg/片的抗贫血药片剂。已知实验室有以下仪器:100 mL容量瓶、500 mL容量瓶、酸式滴定管、碱式滴定管,其他仪器任选,1×10-3 mol·L-1 Fe3+标准溶液,其他试剂若干。
(1)补血剂中铁元素均为亚铁化合物,而不用三价铁的化合物,这是因为__________。
A.Fe3+易水解生成Fe(OH)3,不利于吸收
B.Fe3+易被还原成Fe2+,不便于在空气中保存
C.Fe3+有强氧化性,对人体有腐蚀、刺激作用
D.三价铁有毒
(2)比色实验必须用到的专用仪器是;
实验前必须检漏的仪器是__________;
必须用待装液润洗的仪器是__________;
取用Fe3+标准液要选__________滴定管。
(3)Fe3+易水解,使溶液显__________性,溶液越稀Fe3+的水解百分比越__________,因此要加入__________溶液调节pH。
(4)该同学分别取1 mL、2 mL、4 mL、8 mL标准Fe3+溶液配制成25 mL标准色阶,并标号为1、2、3、4。为便于与标准色阶比较,如用1片该药品配制待测液,应选用__________mL容量瓶,溶解药片时,先加少量水溶解,再加入2 mL 1∶1 HNO3,并加盐,目的是____________________。该同学发现待测液与色阶3颜色最接近,该药品的铁元素含量是否达到3标准值?__________(填“是”或“否”)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com