
题目列表(包括答案和解析)
| 实验方案 | 方案一 | 方案二 |
| 实验操作 | 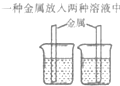 |
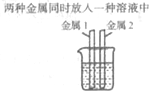 |
 某校课外活动小组模拟工业生产方法,用金属铜粉制取少量硫酸铜.请根据他们的实验操作,回答下面有关问题:
某校课外活动小组模拟工业生产方法,用金属铜粉制取少量硫酸铜.请根据他们的实验操作,回答下面有关问题: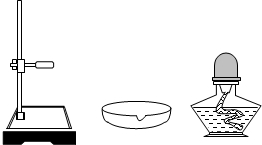
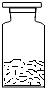 (2013?南岗区一模)张南在实验室发现有一瓶没有标签的白色粉末,可能含有KCl、Na2C03、CaCl2 CaCO3、无CuSO4 中的一种或几种,为确定白色粉末的成分.取该混合物进行以下实验:
(2013?南岗区一模)张南在实验室发现有一瓶没有标签的白色粉末,可能含有KCl、Na2C03、CaCl2 CaCO3、无CuSO4 中的一种或几种,为确定白色粉末的成分.取该混合物进行以下实验:湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com