
题目列表(包括答案和解析)
下列反应达到平衡后,增大压强或升高温度,平衡都向正反应方向移动的是
A.2NO2  N2O4(正反应为放热反应)
N2O4(正反应为放热反应)
B.3O2  2O3(正反应为吸热反应)
2O3(正反应为吸热反应)
C.H2(g)+I2(g)  2HI(g) (正反应为放热反应)
2HI(g) (正反应为放热反应)
D.NH4HCO3(s)  NH3(g)+H2O(g)+CO2(g)
(正反应为吸热反应)
NH3(g)+H2O(g)+CO2(g)
(正反应为吸热反应)
A.H2(气)+I2(气)![]() 2HI(气)
2HI(气)
B.3H2(气)+N2(气)![]() 2NH3(气)
2NH3(气)
C.2SO2(气)+O2(气)![]() 2SO3(气)
2SO3(气)
D.C(固)+CO2(气)![]() 2CO(气)
2CO(气)
实验室将I2溶于KI溶液中,配制浓度较大的碘水,主要是因为发生了反应:
I2(aq)+I-(aq)![]() I-2(aq)上述平衡体系中,I-3的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上的任何一点都表示平衡状态),下列说法不正确的是 ( )
I-2(aq)上述平衡体系中,I-3的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上的任何一点都表示平衡状态),下列说法不正确的是 ( )
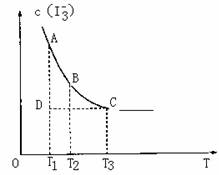
A.该反应的正反应是吸热反应
B.A点与C点的化学反应速率vA<vC
C.在反应进行到D点时, v正<v逆
D.A点与B点相比,B点的c(I2)大
过氧乙酸(C2H4O3)是一种消毒剂。它可由H2O2和冰醋酸反应制取,所以在过氧乙酸中常含有残留的H2O2。测定产品中过氧乙酸浓度c0,涉及下列反应:
①2MnO4―+5H2O2+6H+=2Mn2++5O2+8H2O
②H2O2+2I―+2H+=I2+2H2O
③C2H4O3+2I―+2H+=CH3COOH+I2+H2O
④2S2O32―+I2=S4O62―+2I―
取20mL待测液,用硫酸使溶液酸化,再用浓度为1mol?L―1的KMnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积20mL(反应①,滴定过程中KMnO4不与过氧乙酸反应)
另取20mL待测液,加入过量的KI,并用硫酸使溶液酸化,此时过氧乙酸和残留的H2O2都能跟KI反应生成I2(反应②和③)。再用浓度为3mol?L-1的Na2S2O3标准溶液滴定生成I2,耗用Na2S2O3溶液体积为60mL。
(1)已知过氧乙酸分子部分含有H2O2相同的“结构”,则其结构简式为 。
(2)根据上述实验数据,计算过氧乙酸物质的量浓度。
实验室将I2溶于KI溶液中,配制浓度较大的碘水,主要是因为发生了反应:
I2(aq)+I-(aq)![]() I-2(aq)上述平衡体系中,I-3的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上的任何一点都表示平衡状态),下列说法不正确的是( )
I-2(aq)上述平衡体系中,I-3的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上的任何一点都表示平衡状态),下列说法不正确的是( )
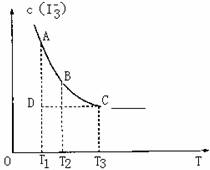
A.该反应的正反应是吸热反应
B.A点与C点的化学反应速率vA<vC
C.在反应进行到D点时, v正<v逆
D.A点与B点相比,B点的c(I2)大
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com