
题目列表(包括答案和解析)
 根据要求回答下列叙述相关问题
根据要求回答下列叙述相关问题| 3 |
| 2 |
| 1 |
| 2 |
| 一定条件 |
| 一定条件 |
| 1 |
| 2 |
C.0.4Q1+0.1Q3 D.0.4Q1+0.2Q2
(共6分)(1)已知CH4(g)+2O2 (g) = CO2 (g) +2H2O (l); △H=-890kJ/mol,现有CH4和CO共0.75mol,完全燃烧后生成CO2气体和18g液态水,并放出515kJ热量,则CO燃烧的热化学方程式为 ;
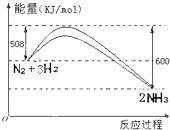
(2)化学反应N2+3H2 2NH3的能量变化如图所示,写出生成氨气时该反应的热化学方程式 。
2NH3的能量变化如图所示,写出生成氨气时该反应的热化学方程式 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com