
题目列表(包括答案和解析)
《化学与技术》模块(选考题)
29.纯碱是一种重要的化工原料。目前制碱工业主要有“氨碱法”和“联合制碱法”两种工艺。请按要求回答问题:
(1)“氨碱法”产生大量CaCl2废弃物,请写出该工艺中产生CaCl2的化学方程式:
;
(2)写出“联合制碱法”有关反应的化学方程式:
;
;
(3)CO2是制碱工业的重要原料,“联合制碱法”与“氨碱法”中CO2的来源有何不同?
;
(4)绿色化学的重要原则之一是提高反应的原子利用率。根据“联合制碱法”总反应,列出计算原子利用率的表达式:
原子利用率(%)= 。
 选考题[化学--选修化学与生活]
选考题[化学--选修化学与生活]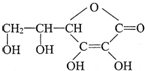 ,它的分子式是
,它的分子式是《化学与技术》模块(选考题)
27.下列有关生铁炼钢的叙述错误的是
A. 添加必要的元素,改善钢材的组织结构和性能
B. 适当降低生铁中的含碳量,除去大部分硫、磷等杂质
C. 加入硅、锰、铝等合金元素调整成分并脱去钢水中的氧
D.除去生铁中的非金属元素
《有机化学基础》模块 (选考题)
21.

根据图示回答下列问题:
(1)写出A、E、G的结构简式:A ,E ,G ;
(2)反应②的化学方程式(包括反应条件)是 ,
反应④化学方程式(包括反应条件)是 ;
(3)写出①、⑤的反应类型:① 、⑤ 。
与氨碱法比较,下列关于联合制碱法优点的判断中不正确的是
A.提高了原料的原子利用率
B.降低了生产成本
C.减少了环境污染
D.减轻了对设备的腐蚀
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com