某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用如图1所示装置进行有关实验.
已知:①SO
2难溶于饱和亚硫酸氢钠溶液.②SO
2能与酸性高锰酸钾溶液发生氧化还原反应.
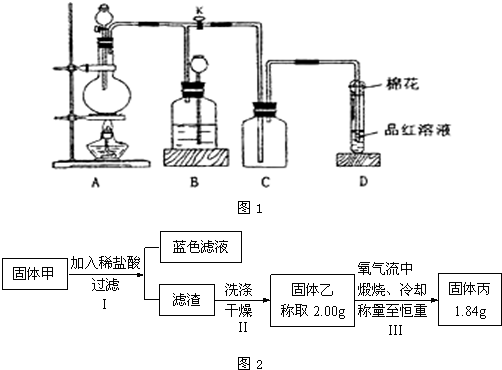
请回答:
(1)装置A中发生的化学反应方程式为
Cu+2 H
2SO
4(浓)
CuSO
4+SO
2↑+2 H
2O
Cu+2 H
2SO
4(浓)
CuSO
4+SO
2↑+2 H
2O
.此反应表明浓硫酸具有(填字母)
ac
ac
.
a.酸性 b.脱水性 c.强氧化性 d.吸水性
(2)装置D中试管口放置的棉花中浸入
NaOH
NaOH
溶液,其作用是
吸收SO2气体,防止污染空气
吸收SO2气体,防止污染空气
.
(3)装置B的作用是贮存多余的气体.当D处有明显的现象后,关闭旋塞K并移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中的现象是
集气瓶内液面下降,长颈漏斗内液面上升
集气瓶内液面下降,长颈漏斗内液面上升
.B中应放置的液体是(填字母)
b
b
.
a.水 b.饱和NaHSO
3溶液 c.酸性KMnO
4溶液 d.NaOH溶液
(4)实验中,取一定质量的铜片和一定体积18.4mol?L
-1的浓硫酸放在圆底烧瓶中共热,直到反应完毕,发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余.
①有一定量的余酸但未能使铜片完全溶解,你认为原因是
浓硫酸由浓变稀,稀硫酸不再与铜反应
浓硫酸由浓变稀,稀硫酸不再与铜反应
.
②下列药品中能用来证明反应结束后的烧瓶中确有余酸的是(填字母)
b、d
b、d
.
a.银粉 b.铁粉 c.BaCl
2溶液 d.NaHCO
3溶液
(5)实验中发现试管内除了产生白色固体外,在铜表面还产生黑色固体甲,其中可能含有氧化铜、硫化铜、硫化亚铜,以及被掩蔽的氧化亚铜.
查阅资料:
i.氧化亚铜在酸性环境下会发生自身氧化还原反应生成Cu
2+和铜单质,在氧气流中煅烧,可以转化为氧化铜.
ii.硫化铜和硫化亚铜常温下都不溶于稀盐酸,在氧气流中煅烧,硫化铜和硫化亚铜都转化为氧化铜和二氧化硫.
为了研究甲的成分,该小组同学在收集到足够量的固体甲后,进行了如图2所示实验:
①Ⅲ中在煅烧过程中一定发生的反应的化学方程式为
.
②下列对于固体甲的成分的判断中,正确的是(填字母选项)
a c d
a c d
.
a.固体甲中,CuO和Cu
2O至少有一种
b.固体甲中,CuS和Cu
2S不能同时存在
c.固体甲中若没有Cu
2O,则一定有Cu
2S
d.固体甲中若存在Cu
2O,也可能有Cu
2S.

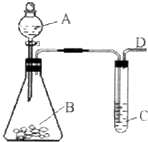 某同学用如图所示的装置来探究SO2的性质及有关实验.
某同学用如图所示的装置来探究SO2的性质及有关实验.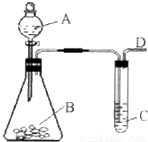

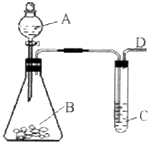 (2009?福州一模)某同学用如图所示的装置来探究SO2的性质及有关实验.
(2009?福州一模)某同学用如图所示的装置来探究SO2的性质及有关实验.