
题目列表(包括答案和解析)
铁是人类较早使用的金属之一。运用铁的有关知识,回答下列各题。
(1)据有关报道。目前已能冶炼出纯度高达99.9999%的铁,下列关于纯铁的叙述中,正确的是 (填字母)。
A.硬度比碳素钢小,熔点比碳素钢高 B.不能与盐酸反应
C.与不锈钢成分相同 D.在冷的浓硫酸中钝化
(2)向沸水中逐滴滴加饱和FeCl3溶液,至液体呈透明的红褐色时停止加热,所得分散系的分散质大小范围是 。
(3)合成氨工业生产中常用铁触媒做催化剂,其主要成分是FeO、Fe2O3。已知某铁触媒中,铁、氧离子的物质的量之比为4∶5,其中Fe2+与Fe3+物质的量之比为________。
(4)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板。请写出FeCl3溶液与铜反应的离子方程式: 。用于检验反应后的溶液中是否存在Fe3+的试剂是 。
(5)欲从(4)腐蚀后的废液中回收铜并重新获得FeCl3溶液。下列试剂中,需要用到的一组是 (填字母)。
①蒸馏水 ②铁粉 ③浓硝酸 ④浓盐酸 ⑤浓氨水 ⑥氯水
A.①②④⑥ B.①③④⑥ C.②④⑤ D.①④⑥
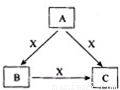
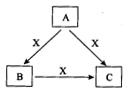
A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图所示。
请针对以下不同情况回答:
(1)若A、B、C的焰色反应均呈黄色,水溶液均为碱性。
①A中所含有的化学键是_____________。
②将4.48 L(标准状况下)X通入100mL3 mol/L A的水溶液后,溶液中离子浓度由大到小的顺序为_______________________________________。
③自然界中存在B、C和H2O按一定比例结晶而成的固体。取一定量该固体溶于水配成100mL溶液,测得溶溶中金属阳离子的浓度为0.5 mol/L。若取相同质量的固体加热至恒重,剩余固体的质量为__________。
(2)若A为固态非金属单质,A与X同周期,常温常压下C为白色固体,B分子中各原子最外层均为8e![]() 结构。
结构。
①下列有关B物质的叙述正确的是
a、B的分子式为AX b、B为共价化合物
c、B分子呈三角锥形 d、B性质稳定,不与除X外的任何物质发生化学反应
②C与水剧烈反应,生成两种常见酸,反应的化学方程式为 。
A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图所示。
请针对以下不同情况回答:
(1)若A、B、C的焰色反应均呈黄色,水溶液均为碱性。
①A中所含有的化学键是_____________。
②将4.48 L(标准状况下)X通入100mL 3 mol/L A的水溶液后,溶液中离子浓度由大到小的顺序 为_______________________________________。
为_______________________________________。
③自然界中存在B、C和H2O按一定比例结晶而成的固体。取一定量该固体溶于水配成100mL溶液,测得溶溶中金属阳离子的浓度为0.5 mol/L。若取相同质量的固体加热至恒重,剩余固体的质量为__________。
(2)若A为固态非金属单质,A与X同周期,常温常压下C为白色固体,B分子中各原子最外层均为8e 结构。
结构。
①下列有关B物质的叙述正确的是
a、B的分子式为AX b、B为共价化合物
c、B分子呈三角锥形 d、B性质稳定,不与除X外的任何物质发生化学反应
②C与水剧烈反应,生成两种常见酸,反应的化学方程式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com