
题目列表(包括答案和解析)
A.若温度不变,将容器体积增大一倍,此时A的浓度变为原来的0.48倍,则m+n>p+q??
B.若平衡时,A的转化率比B大,说明反应开始时,A与B的物质的量之比大于m∶n??
C.若m+n=p+q,则往含有a mol 气体的平衡体系中再加入b mo1 B,达到新平衡时,气体的总的物质的量等于(a+b)mol??
D.温度不变时,若压强增大至原来的2倍,达到新平衡时,总体积一定比原体积的![]() 要小
要小
|
对于平衡体系mA(g)+nB(g) | |
A. |
若平衡时 |
B. |
若温度不变,将容器的体积增大1倍,此时A的浓度变为原来的0.45倍,则m+n>p+q |
C. |
若m+n=p+q,则往含有amol气体的平衡体系中再加入bmolB,达到新平衡时,气体的总物质的量等于(a+b)mol |
D. |
若升高温度时,平衡混合气体的平均相对分子质量增大,则m+n>p+q |
(13分)合成氨工业对国民经济和社会发展具有重要的意义。其原理为:
N2(g)+3H2(g) 2NH3(g) △H= -92.4 kJ/mol 据此回答以下问题:
(1)合成氨工业采取的下列措施中,不能用勒沙特列原理解释的是 (填序号)。
①反应压强为20Mpa~50Mpa ②500℃的高温 ③铁触媒作催化剂 ④将生成的氨液化并及时从体系中分离出来,未反应的N2、H2循环到合成塔中。
(2)一定条件下NH3的平衡体积分数随n(N2)变化如图所示(T-温度)。则T2 T1(填>、=、<),判断的依据是:
(3)合成氨气所需的氢气可以由水煤气分离得到。涉及反应信息如下:
反应一:C(s)+H2O(g) H2(g)+CO(g) 平衡常数K1
反应二:CO(g)+H2O(g) H2(g)+CO2(g) 平衡常数K2
① K1的表达式:K1=
②将一定量的H2O(g)和CO(g)分别通入到体积为1L的密闭容器中,在不同条件下进行反应,得到以下三组数据:
| 实验组别 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 1 | 2 | 0.8 | 1.2 | 5 |
| 2 | 900 | 0.5 | 1 | 0.2 | 0.8 | 3 |
| 3 | T | a | b | c | d | t |
(Ⅰ)实验1中,用CO2表示反应开始到平衡的平均反应速率为
(Ⅱ) 在实验3,当a=0.5、b=1时,要使c、d数据与实验2相同,且t<3,可以采取的措施为 (填序号)
A.其它条件不变温度T<900℃ B.其它条件不变温度T>900℃
C.充入一定量氖气 D.使用高效催化剂
(Ⅲ)对于反应二,当升高温度时K2 (填“增大”、“减小”或“不变”)。
(13分)合成氨工业对国民经济和社会发展具有重要的意义。其原理为:
N2(g)+3H2(g)  2NH3(g) △H=" -92.4" kJ/mol 据此回答以下问题:
2NH3(g) △H=" -92.4" kJ/mol 据此回答以下问题:
(1)合成氨工业采取的下列措施中,不能用勒沙特列原理解释的是 (填序号)。
①反应压强为20Mpa~50Mpa ②500℃的高温 ③铁触媒作催化剂 ④将生成的氨液化并及时从体系中分离出来,未反应的N2、H2循环到合成塔中。
(2)一定条件下NH3的平衡体积分数随n(N2)变化如图所示(T-温度)。则T2 T1(填>、=、<),判断的依据是: 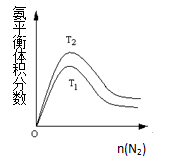
(3)合成氨气所需的氢气可以由水煤气分离得到。涉及反应信息如下:
反应一:C(s)+H2O(g)  H2(g)+CO(g) 平衡常数K1
H2(g)+CO(g) 平衡常数K1
反应二:CO(g)+H2O(g)  H2(g)+CO2(g) 平衡常数K2
H2(g)+CO2(g) 平衡常数K2
① K1的表达式:K1=
②将一定量的H2O(g)和CO(g)分别通入到体积为1L的密闭容器中,在不同条件下进行反应,得到以下三组数据:
| 实验组别 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 1 | 2 | 0.8 | 1.2 | 5 |
| 2 | 900 | 0.5 | 1 | 0.2 | 0.8 | 3 |
| 3 | T | a | b | c | d | t |
(13分)合成氨工业对国民经济和社会发展具有重要的意义。其原理为:
N2(g)+3H2(g)  2NH3(g) △H= -92.4 kJ/mol 据此回答以下问题:
2NH3(g) △H= -92.4 kJ/mol 据此回答以下问题:
(1)合成氨工业采取的下列措施中,不能用勒沙特列原理解释的是 (填序号)。
①反应压强为20Mpa~50Mpa ②500℃的高温 ③铁触媒作催化剂 ④将生成的氨液化并及时从体系中分离出来,未反应的N2、H2循环到合成塔中。
(2)一定条件下NH3的平衡体积分数随n(N2)变化如图所示(T-温度)。则T2 T1(填>、=、<),判断的依据是:

(3)合成氨气所需的氢气可以由水煤气分离得到。涉及反应信息如下:
反应一:C(s)+H2O(g)  H2(g)+CO(g)
平衡常数K1
H2(g)+CO(g)
平衡常数K1
反应二:CO(g)+H2O(g)  H2(g)+CO2(g) 平衡常数K2
H2(g)+CO2(g) 平衡常数K2
① K1的表达式:K1=
②将一定量的H2O(g)和CO(g)分别通入到体积为1L的密闭容器中,在不同条件下进行反应,得到以下三组数据:
|
实验组别 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
||
|
H2O |
CO |
H2 |
CO |
|||
|
1 |
650 |
1 |
2 |
0.8 |
1.2 |
5 |
|
2 |
900 |
0.5 |
1 |
0.2 |
0.8 |
3 |
|
3 |
T |
a |
b |
c |
d |
t |
(Ⅰ)实验1中,用CO2表示反应开始到平衡的平均反应速率为
(Ⅱ) 在实验3,当a=0.5、b=1时,要使c、d数据与实验2相同,且t<3,可以采取的措施为 (填序号)
A.其它条件不变温度T<900℃ B.其它条件不变温度T>900℃
C.充入一定量氖气 D.使用高效催化剂
(Ⅲ)对于反应二,当升高温度时K2 (填“增大”、“减小”或“不变”)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com