能源的开发利用与人类社会的可持续性发展息息相关.
I已知:Fe
2O
3(s)+3C(s)=2Fe(s)+3CO(g)△H
1=akJ?mol
-1CO(g)+O2=CO2(g)△H
2=bkJ?mol
-14Fe(s)+3O
2(g)=2Fe
2O
3(s)△H
3=ckJ?mol
-1则C的燃烧热
kJ.mol
-1II(I)依据原电池的构成原理,下列化学反应在理论上可以设计成原电池的是
(填序号).
A.C(s)+C0
2(g)=2C0(g)
B.Na0H(aq)+HCl(aq)=NaCl(aq)+H
20(1)
C.2H
20(l)=2H
2(g)+0
2(g)
D.2C0(g)+0
2(g)=2C0
2(g)
若以熔融的K
2CO
3与CO
2为反应的环境,依据所选反应设计成一个原电池,诸写出该原电池的负极反应:
.
(2)某实验小组模拟工业合成氨反应N
2+3H
22NH
3△H=-92.4kJ?mol
-1,开始他们将N
2和H
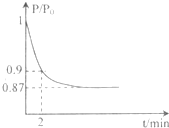
2混合气体20mol(体积比1:1)充入5L合成塔中.反应 前压强为P
0,反应过程中压强用P表示,反应过程中
与时间t的关系如图所示.请回答下列问题:
①反应达平衡的标志是(填字母代号)
A.压强保持不变
B.气体密度保持不变
C.NH
3的生成速率是N
2的生成速率的2倍
②2min时,以C(N
2)变化表示的平均反应速率为
③若提高N
2的转化率可采取的措施有
A.向体系中按体积比1:1再充入N2和H2 B.分离出NH3
C.升高温度 D.充入He气使压强增大 E.加入一定量的N2
(3)25°C时,BaCO
3和BaSO
4的溶度积常数分别是8×10
-9和1×10
-10,某含有BaCO
3沉淀的悬浊液中,
c(C)=0.2mol?L-1,如果加入等体积的Na
2SO
4溶液,若要产生 BaSO
4沉淀,加入Na
2SO
4溶液的物质的量浓度最小是
mol?L
-1.

 能源的开发利用与人类社会的可持续性发展息息相关.
能源的开发利用与人类社会的可持续性发展息息相关.