教材中给出的各物质的第一电离能的数据如下:
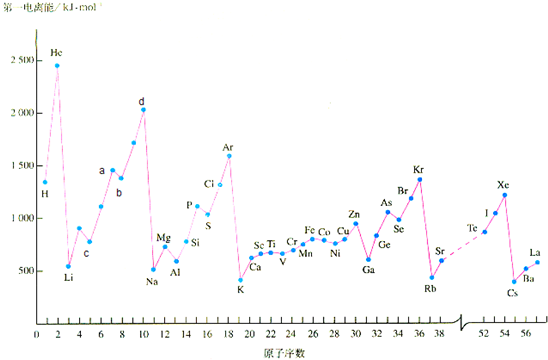
请回答下列问题:
(1)a点代表的元素是
.a点的第一电离能比b点高理由是:
.
(2)d点代表的元素的第一电离能处在峰顶原因是:
.稀有气体中的Xe能形成氧化物XeO
3,已知该氙原子上有1对孤对电子,则XeO
3分子构型为
型结构;Xe的杂化类型为
.
(3)上图中也给出了过渡元素的第一电离能数据,他们都与核外电子的排布有关,则Cu的外围电子排布式为:
.
(4)Mn 元素的外围电子排布式为3d
54s
2,Fe元素的外围电子排布式为3d
64s
2,请解释Mn的第三电离能比Fe的第三电离能大的原因是:
.

