
题目列表(包括答案和解析)
Ⅰ.甲醇是一种新型的能源。
(1)合成气(组成为H2和CO)是生产甲醇的重要原料,请写出由焦炭和水在高温下制取合成气的化学方程式 。
(2)已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ·mol-1、-283.0kJ·mol-1和-726.5kJ·mol-1,则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为 ;
(3)在容积为l L的密闭容器中,由CO和H2合成甲醇。在其他条件不变的情况下,考查温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300℃);

下列说法正确的是 (填序号)
A.温度为T1时,从反应开始到平衡,生成甲醇的平均速率为v(CH3OH)= (mol·L-1·min-1)
(mol·L-1·min-1)
B.该反应在T1时的平衡常数比T2时的大
C.该反应为吸热反应
D.处于A点的反应体系从T1变到T2,达到平衡时 减小
减小
(4)在T1温度时,将1 mol CO和2mol H2充入一密闭恒容容器中,充分反应达到平衡后,若CO转化率为a,则容器内的压强与起始压强之比为 ;
(5)在直接以甲醇为燃料的电池中,电解质溶液为碱性,负极的反应式为 ;假设原电解质为NaOH,且电池工作一段时间后溶质只有Na2CO3,此时溶液中各离子浓度大小关系为
Ⅱ.已知Ksp(AgCl)=1.56×10-10 ,Ksp(AgBr)=7.7×10-13 ,Ksp(Ag2CrO4)=9×10-11。某溶液中含有C1-, Br-和CrO42-,浓度均为0.010mo1·L-1,向该溶液中逐滴加入0.010mol·L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为 。
Ⅰ.甲醇是一种新型的能源。
(1)合成气(组成为H2和CO)是生产甲醇的重要原料,请写出由焦炭和水在高温下制取合成气的化学方程式 。
(2)已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ·mol-1、-283.0kJ·mol-1和-726.5kJ·mol-1,则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为 ;
(3)在容积为l L的密闭容器中,由CO和H2合成甲醇。在其他条件不变的情况下,考查温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300℃);
下列说法正确的是 (填序号)
A.温度为T1时,从反应开始到平衡,生成甲醇的平均速率为v(CH3OH)=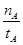 (mol·L-1·min-1) (mol·L-1·min-1) |
| B.该反应在T1时的平衡常数比T2时的大 |
| C.该反应为吸热反应 |
D.处于A点的反应体系从T1变到T2,达到平衡时 减小 减小 |
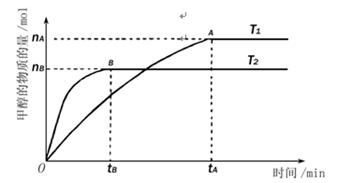
A.温度为T1时,从反应开始到平衡,生成甲醇的平均速率为v(CH3OH)=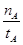 (mol·L-1·min-1) (mol·L-1·min-1) |
| B.该反应在T1时的平衡常数比T2时的大 |
| C.该反应为吸热反应 |
D.处于A点的反应体系从T1变到T2,达到平衡时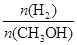 减小 减小 |
能源问题是人类社会面临的重大课题.燃料电池作为一种新型能源,由于其电极材料丰富,电解质多种多样,将渗透到我们生活的各个领域.
(1)碱性燃料电池采用30%~50% KOH溶液作电解质溶液,以H2为燃料,在一定条件下使其发生反应,该电池的电极反应式为:
正极:________________;负极:________________.
电池工作过程中OH-向________极移动,电解质溶液的pH将________(填“变大”“变小”或“不变”).
(2)若以甲醇作燃料,则它将发生________反应,若要使甲醇在电池中的反应顺利进行,在该电池中除了电极材料外,可能还需要的条件是( )
A.点燃 B.催化剂 C.高压 D.某种电解质
(3)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液.肼-空气燃料电池放电时,负极的电极反应式是:N2H4+4OH――4e-=N2+4H2O,正极的电极反应式是:________________.工作时________极区pH相对较大.下图是一个电化学过程示意图.
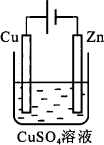
①Cu片上发生的电极反应式为:________.
②假设使用肼-空气燃料电池为本过程中的电源,铜片的质量变化为128 g.则肼-空气燃料电池理论上消耗标准状况下的空气________L(假设空气中氧气的体积含量为20%).
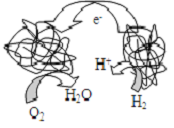 科学家们发明了一种新型燃料电池.该电池包括两个涂覆着酶的电极,它们处于充满空气和少量氢气的玻璃槽中.由于气体可以混合,从而省去了昂贵的燃料隔膜,其工作原理如图.下列说法中不正确的是( )
科学家们发明了一种新型燃料电池.该电池包括两个涂覆着酶的电极,它们处于充满空气和少量氢气的玻璃槽中.由于气体可以混合,从而省去了昂贵的燃料隔膜,其工作原理如图.下列说法中不正确的是( )湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com