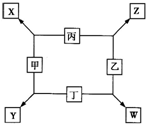
甲、乙、丙、丁均是由短周期元素组成的单质,X、Y、Z、W均为化合物,常温下,X为淡黄色固体,Z遇空气变为红棕色,W能使湿润的红色石蕊试纸变蓝色,工业上常用W来制取Z,其转化关系如右图所示.
请回答下列问题:
(1)X中化学键类型为
离子键、非极性键
离子键、非极性键
.实验室制备W的化学方程式为
2NH
4Cl+Ca(OH)
2CaCl
2+2NH
3↑+2H
2O
2NH
4Cl+Ca(OH)
2CaCl
2+2NH
3↑+2H
2O
.
(2)将题小粒甲投入FeCl
3溶液中,可观察到的主要现象是
钠融化为小球,在液面上四处游动,发出嘶嘶声,最后消失,有红褐色沉淀产生
钠融化为小球,在液面上四处游动,发出嘶嘶声,最后消失,有红褐色沉淀产生
.
(3)写出下列反应的化学方程式:
①工业上用W制取Z:
;
②Y与水反应生成丁:
NaH+H2O=NaOH+H2↑
NaH+H2O=NaOH+H2↑
.在②中,氧化产物和还原产物的质量之比为
1:1
1:1
.
(4)在绿矾形成的溶液中加入适量的X,二者恰好完全反应,写出此反应的离子方程式:
4Na2O2+4Fe2++2H2O=4Fe(OH)3↓+8Na++O2↑
4Na2O2+4Fe2++2H2O=4Fe(OH)3↓+8Na++O2↑
.
(5)工业上制备W的条件为
高温、高压和催化剂
高温、高压和催化剂
,选择该条件的理由是
氮气分子中存在三键,很稳定,选择高温是由于催化剂活性需要一定温度,且加快化学反应速率,选择高压是为了加快反应速率和提高原料的转化率
氮气分子中存在三键,很稳定,选择高温是由于催化剂活性需要一定温度,且加快化学反应速率,选择高压是为了加快反应速率和提高原料的转化率
.

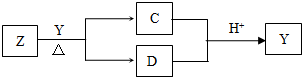 Y是短周期元素组成的单质,为淡黄色固体.Z是一种化合物,焰色反应呈黄色,0.1mol?L-1 Z的水溶液pH=13;C、Y、D都含同一种元素,且此元素化合价依次升高.C、D的水溶液均显碱性.
Y是短周期元素组成的单质,为淡黄色固体.Z是一种化合物,焰色反应呈黄色,0.1mol?L-1 Z的水溶液pH=13;C、Y、D都含同一种元素,且此元素化合价依次升高.C、D的水溶液均显碱性.






 甲、乙、丙、丁均是由短周期元素组成的单质,X、Y、Z、W均为化合物,常温下,X为淡黄色固体,Z遇空气变为红棕色,W能使湿润的红色石蕊试纸变蓝色,工业上常用W来制取Z,其转化关系如右图所示.
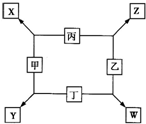
甲、乙、丙、丁均是由短周期元素组成的单质,X、Y、Z、W均为化合物,常温下,X为淡黄色固体,Z遇空气变为红棕色,W能使湿润的红色石蕊试纸变蓝色,工业上常用W来制取Z,其转化关系如右图所示. 甲、乙、丙、丁均是由短周期元素组成的单质,X、Y、Z、W均为化合物,常温下,X为淡黄色固体,Z遇空气变为红棕色,W能使湿润的红色石蕊试纸变蓝色,工业上常用W来制取Z,其转化关系如右图所示.
甲、乙、丙、丁均是由短周期元素组成的单质,X、Y、Z、W均为化合物,常温下,X为淡黄色固体,Z遇空气变为红棕色,W能使湿润的红色石蕊试纸变蓝色,工业上常用W来制取Z,其转化关系如右图所示.