
题目列表(包括答案和解析)
(16分)(Ⅰ)本世纪是生命科学研究的昌盛时期, 科学家研究发现,进入生物体内的氧分子,可接受1个电子转变为超氧阴离子自由基(O2-),进而引发产生一系列自由基。一切需氧生物在其机体内均有一套完整的活性氧系统(抗氧化酶和抗氧化剂),能将活性氧转变为活性较低的物质,机体因此受到保护。人们利用羟胺(NH2OH)氧化的方法可以检测其生物系统中O2-含量,原理是O2-与羟胺反应生成NO2-和一种过氧化物。NO2-在对氨基苯磺酸和α-萘胺作用下,生成粉红的偶氮染体,染体在波长530nm处有显著吸收,且其吸收值与c(NO2-)成正比,从而可计算出样品中的O2-含量。某实验室用以上方法处理后测得溶液中c(NO2-)=2.500×10-3 mol?L-1。
科学家研究发现,进入生物体内的氧分子,可接受1个电子转变为超氧阴离子自由基(O2-),进而引发产生一系列自由基。一切需氧生物在其机体内均有一套完整的活性氧系统(抗氧化酶和抗氧化剂),能将活性氧转变为活性较低的物质,机体因此受到保护。人们利用羟胺(NH2OH)氧化的方法可以检测其生物系统中O2-含量,原理是O2-与羟胺反应生成NO2-和一种过氧化物。NO2-在对氨基苯磺酸和α-萘胺作用下,生成粉红的偶氮染体,染体在波长530nm处有显著吸收,且其吸收值与c(NO2-)成正比,从而可计算出样品中的O2-含量。某实验室用以上方法处理后测得溶液中c(NO2-)=2.500×10-3 mol?L-1。
⑴ 请根据测定原理写出有关反应的离子方程式 ▲ ;
⑵ 计算该样品此时c(O2-) = ▲ ;
⑶ 如用羟胺氧化法测定O2-时,将其生成的过氧化物作为检测物,若选用氧化还原法进行定量分析(用KMnO4标准溶液进行滴定)
① 请写出其测定原理的反应方程式 ▲ ;
② 测定所用的主要玻璃仪器为 ▲ ,通过观察 ▲ 的现象可确定测定反应是否进行完全。
(Ⅱ)水中的NO2-是含氮有机物分解的产物,其浓度的大小是水源污染的标志之一。检测水中的NO2-可用比色法,其步骤是:
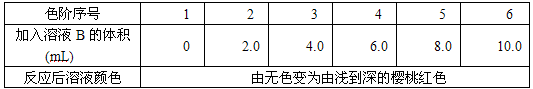
a. 配制标准溶液:称取0.30gNaNO2,溶于水后在容量瓶中稀释至1L得溶液A,移取5mL溶液A,稀释至1L,得溶液B。
b. 配制标准色阶:取6只规格为10mL的比色管(即质地、大小、厚薄相同且具塞的平
底试管),分别加入体积不等的溶液B,并稀释至10mL,再加入少许(约0.3g)对苯磺酸粉末,实验结果如下表所示:
| 色阶序号 | 1 | 2 | 3 | 4 | 5 | 6 |
| 加入溶液B的体积(mL) | 0 | 2.0 | 4.0 | 6.0 | 8.0 | 10.0 |
| 反应后溶液颜色 | 由无色变为由浅到深的樱桃红色 | |||||
 科学家研究发现,进入生物体内的氧分子,可接受1个电子转变为超氧阴离子自由基(O2-),进而引发产生一系列自由基。一切需氧生物在其机体内均有一套完整的活性氧系统(抗氧化酶和抗氧化剂),能将活性氧转变为活性较低的物质,机体因此受到保护。人们利用羟胺(NH2OH)氧化的方法可以检测其生物系统中O2-含量,原理是O2-与羟胺反应生成NO2-和一种过氧化物。NO2-在对氨基苯磺酸和α-萘胺作用下,生成粉红的偶氮染体,染体在波长530nm处有显著吸收,且其吸收值与c(NO2-)成正比,从而可计算出样品中的O2-含量。某实验室用以上方法处理后测得溶液中c(NO2-)=2.500×10-3 mol?L-1。
科学家研究发现,进入生物体内的氧分子,可接受1个电子转变为超氧阴离子自由基(O2-),进而引发产生一系列自由基。一切需氧生物在其机体内均有一套完整的活性氧系统(抗氧化酶和抗氧化剂),能将活性氧转变为活性较低的物质,机体因此受到保护。人们利用羟胺(NH2OH)氧化的方法可以检测其生物系统中O2-含量,原理是O2-与羟胺反应生成NO2-和一种过氧化物。NO2-在对氨基苯磺酸和α-萘胺作用下,生成粉红的偶氮染体,染体在波长530nm处有显著吸收,且其吸收值与c(NO2-)成正比,从而可计算出样品中的O2-含量。某实验室用以上方法处理后测得溶液中c(NO2-)=2.500×10-3 mol?L-1。| 色阶序号 | 1 | 2 | 3 | 4 | 5 | 6 |
| 加入溶液B的体积(mL) | 0 | 2.0 | 4.0 | 6.0 | 8.0 | 10.0 |
| 反应后溶液颜色 | 由无色变为由浅到深的樱桃红色 | |||||
2005年江苏酸雨污染有所加重,酸雨发生频率为34.1%,上升了6.2个百分点,每三场雨中就有一场多是酸雨。某校研究性学习小组拟对本市空气中二氧化硫含量(![]() )进行测定。经查阅资料可采用以下方法:
)进行测定。经查阅资料可采用以下方法:
实验原理:大气中的二氧化硫用甲醛溶液吸收后,生成稳定的羟甲基磺酸加成化合物,再加入氢氧化钠使加成化合物分解,释放出二氧化硫,与副玫瑰苯胺、甲醛作用,生成紫红色化合物。据其颜色深浅,用分光光度计在577nm处进行测定。
分光光度计是利用分光光度法对物质进行定量、定性分析的仪器。而分光光度法则是通过测定被测物质在特定波长时光的吸收度,对该物质进行定性和定量分析。其工作原理可以简单地用公式表示为![]() ,其中A为吸光度,K为一定条件下的常数,c为溶液浓度。
,其中A为吸光度,K为一定条件下的常数,c为溶液浓度。

实验步骤:
(1)采样:
①若你是该兴趣小组成员,你对采样的地点和时间有何建议:
②用图装置采样。通过50L空气后,将吸收液移入100mL容量瓶,用少量吸收液分两次洗涤吸收装置,合并洗涤液于容量瓶中,定容备用。用多孔球泡而不用导管的原因是
(2)吸光度与![]() 含量标准曲线的绘制:在6支25mL比色管中,用每毫升含25
含量标准曲线的绘制:在6支25mL比色管中,用每毫升含25![]() 二氧化硫的标准液配置下表中的标准
二氧化硫的标准液配置下表中的标准![]() 含量系列。
含量系列。
二氧化硫标准系列
| 管号 | 0 | 1 | 2 | 3 | 4 | b |
| 标准液/mL | 0 | 0.20 | 0.40 | 0.60 | 0.80 | 1.00 |
| 吸收液/mL | 10.00 | 9.80 | 9.60 | 9.40 | 9.20 | 9.00 |
| 二氧化硫含量/ | 0 | 5.00 | 10.00 | 15.00 | 20.00 | 25.00 |
用10mL比色皿,以水为参比,测定各管吸光度,实验结果如下。
| 管 号 | 0 | 1 | 2 | 3 | 4 | 5 |
| 吸光度 | 0 | 0.20 | 0.40 | 0.60 | 0.80 | 1.00 |
以吸光度值为纵坐标,二氧化硫含量(![]() )为横坐标,绘制标准曲线。
)为横坐标,绘制标准曲线。
(3)准确量取容量瓶中溶液10mL加人比色皿,测得其吸光度值为0.24,则空气中二氧化硫含量为 ![]() 。我国环境空气质量标准中对每次空气质量测定中
。我国环境空气质量标准中对每次空气质量测定中![]() 的最高浓度限值(m9/m3):一级标准:0.15,二级标准:0.50,三级标准:0.70。则该市空气为 级标准。
的最高浓度限值(m9/m3):一级标准:0.15,二级标准:0.50,三级标准:0.70。则该市空气为 级标准。
(4)甲、乙两组同学测定结果相差较大,试分析乙组同学测定空气中![]() 含量偏小的可能原因:(两个所用药品和装置均无问题)
含量偏小的可能原因:(两个所用药品和装置均无问题)
(5)请你提出江苏防治酸雨的两条主要措施:
《物质结构与性质》模块试题
1.下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。

试回答下列问题:
(1)请写出元素o的基态原子电子排布式 ① 。
(2)d的氢化物的分子构型为 ② ,中心原子的杂化形式为 ③ ;k在空气中燃烧产物的分子构型为 ④ ,中心原子的杂化形式为 ⑤ ,该分子是 ⑥ (填“极性”或“非极性”)分子。
(3)第三周期8种元素按单质熔点高低的顺序如下图,其中序号“8”代表 ⑦ (填元素符号);其中电负性最大的是 ⑧ (填下图中的序号)。

(4)由j原子跟c原子以1∶1相互交替结合而形成的晶体,晶型与晶体j相同。两者相比熔点更高的是 ⑨ ,试从结构角度加以解释: ⑩ 。
(5)i单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。

若已知i的原子半径为d,NA代表阿伏加德罗常数,i的相对原子质量为M,请回答:
①晶胞中i原子的配位数为![]() ,一个晶胞中i原子的数目为
,一个晶胞中i原子的数目为![]() 。
。
②该晶体的密度为![]() (用字母表示)。
(用字母表示)。
2.有A、B、C、D、E、F、G七种元素,除E为第四周期元素外其余均为短周期元素。A、E、G位于元素周期表的s区,其余元素位于p区,A、E的原子外围电子层排布相同,A的原子中没有成对电子;B元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子总数相同;C元素原子的外围电子层排布式为nsnnpn+1;D元素的第一电离能列同周期主族元素第三高;F的基态原子核外成对电子数是成单电子数的3倍;G的基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数均相同。回答下列问题:
(1)写出下列元素的符号:D ① ,G ② 。
(2)D的前一元素第一电离能高于D的原因: ③ 。
(3)由A、B、C形成的ABC分子中,含有 ④ 个σ键, ⑤ 个π键。
(3)由D、E、F、G形成的盐E2DF4、GDF4的共熔体在冷却时首先析出的物质是 ⑥ (写化学式),原因是 ⑦ 。
《有机化学基础》模块试题
3.M5纤维是近年来开发出的一种超高性能纤维,它比现有的防爆破材料轻35%,用它制成的头盔、防弹背心和刚性前后防护板,在战争中保住了很多士兵的生命,M5纤维是线型结构且又有分子间氢键的聚合物,在三维方向x、y、z上,当方向z是聚合物主链方向时,在x方向和y方向上的氢键是其晶体结构的特征。下面是M5纤维的合成路线(部分反应未注明条件):

请回答:
(1)合成M5的单体的结构简式:F ① ,G ② 。
(2)反应类型:A![]() B: ③ ,B
B: ③ ,B![]() C: ④ 。
C: ④ 。
(3)生成A的同时可能生成的A的同分异构体: ⑤ 。
(4)写出化学反应方程式:C![]() 对苯二甲酸: ⑥ ;D
对苯二甲酸: ⑥ ;D![]() E: ⑦ 。
E: ⑦ 。
(5)1 mol的F与NaHCO3溶液反应,最多耗NaHCO3 ⑧ mol。
(6)M5纤维分子间为什么会有氢键?请分析说明: ⑨ 。
4.现有A、B、C、D四种有机物,已知:它们的相对分子质量都是104;A是芳香烃,B、C、D均为烃的含氧衍生物,四种物质分子内均没有甲基;A、B、C、D能发生如下反应生成高分子化合物X、Y、Z(反应方程式未注明条件):
①nA![]() X ②nB
X ②nB![]() Y(聚酯)+nH2O ③nC+nD
Y(聚酯)+nH2O ③nC+nD![]() Z(聚酯)+2nH2O
Z(聚酯)+2nH2O
请按要求填空:
(1)A的结构简式是 ① ,Z的结构简式是 ② 。
(2)在A中加入少量溴水并振荡,所发生反应的化学方程式: ③ 。
(3)B的同分异构体有多种,其中分子中含结构![]() 的同分异构体的结构简式分别是 ④ 。
的同分异构体的结构简式分别是 ④ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com