
题目列表(包括答案和解析)
| A.硫酸工业中,在接触室安装热交换器是为了循环利用反应放出的热量 |
| B.工业上用热还原法冶炼铝:Al2O3+CO═3CO2+2Al |
| C.在铁管上镀铜时,用铁管做电解池阴极,铜块做阳极 |
| D.工业合成氨生产中,适当提高原料气中氮气的含量,可提高H2的转化率 |
氮气和氢气合成氨是化学工业中极为重要的反应,其热化学方程式可表示为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92kJ·mol-1
2NH3(g) ΔH=-92kJ·mol-1
请回答下列问题:
(1)取1 mol N2(g)和3 molH2(g)放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量 92kJ(填“大于”、“等于”或“小于”), 原因是
;若加入催化剂,ΔH (填“变大”、“变小”或“不变”)。
(2)下列有关合成氨反应速率的叙述,不正确的是 (选填序号)。
a.升高温度可以增大活化分子百分数,加快反应速率
b.增大压强不能增大活化分子百分数,但可以加快反应速率
c.使用催化剂可以使反应物分子平均能量升高,加快反应速率
d.在质量一定的情况下,催化剂颗粒的表面积大小,对反应速率有显著影响
e.温度升高,其平衡常数数值变小
(3)已知:分别破坏1mol N![]() N键、1mol H
N键、1mol H![]() H键需要吸收的能量为:946 kJ、436 kJ,则破坏1mol N
H键需要吸收的能量为:946 kJ、436 kJ,则破坏1mol N![]() H键需要吸收的能量为 kJ。
H键需要吸收的能量为 kJ。
(4)N2H4可视为:NH3分子中的H被-NH2取代的产物。
发射卫星用N2H4(g)为燃料,NO2为氧化剂生成N2和H2O(g)。
已知:N2(g)+2O2(g)=2NO2(g) ΔH1=+67.7 kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH2=-534 kJ/mol。
则:1mol N2H4完全反应的热化学方程式为 。
(15分)氮气和氢气合成氨是化学工业中极为重要的反应,其热化学方程式可表示为:N2(g)+3H2(g) 2NH3(g) ΔH=-92kJ·mol-1
2NH3(g) ΔH=-92kJ·mol-1
请回答下列问题:
(1)取1 mol N2(g)和3 molH2(g)放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量 92kJ(填“大于”、“等于”或“小于”) ,原因是
,原因是
;若加入催化剂,ΔH (填“变大”、“变小”或“不变”)。
(2)下列有关合成氨反应速率的叙述,不正确的是 (选填序号)。
a.升高温度可以增大活化分子百分数,加快反应速率
b.增大压强不能增大活化分子百分数,但可以加快反应速率
c.使用催化剂可以使反应物分子平均能量升高,加快反应速率
d.在质量一定的情况下,催化剂颗粒的表面积大小,对反应速率有显著影响
e.温度升高,其平衡常数数值变小
(3)已知:分别破坏1mol N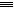 N键、1mol H
N键、1mol H H键需要吸收的能量为:946 kJ、436 kJ,则破坏1mol N
H键需要吸收的能量为:946 kJ、436 kJ,则破坏1mol N H键需要吸收的能量为 kJ。
H键需要吸收的能量为 kJ。
(4)N2H4可视为:NH3分子中的H被-NH2取代的产物。
发射卫星用N2H4(g)为燃料,NO2为氧化剂生成N2和H2O(g)。
已知:N2(g)+2O2(g)=2NO2(g)  ΔH1=+67.7 kJ/mol
ΔH1=+67.7 kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH2=-534 kJ/mol。
则:1mol N2H4完全反应的热化学方程式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com