
题目列表(包括答案和解析)
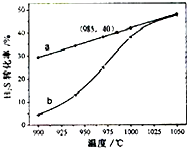 H2S受热分解的反应为:2H2S(g)→2H2(g)+S2(g).在恒温密闭容器中,控制不同温度进行 H2S分解实验.以H2S起始浓度均为cmol?L-1测定H2S的转化率,结果如图.图中a曲线为H2S 的平衡转化率与温度关系,b曲线表示不同温度下反应经过相同时间的转化率.下列叙述错误的是( )
H2S受热分解的反应为:2H2S(g)→2H2(g)+S2(g).在恒温密闭容器中,控制不同温度进行 H2S分解实验.以H2S起始浓度均为cmol?L-1测定H2S的转化率,结果如图.图中a曲线为H2S 的平衡转化率与温度关系,b曲线表示不同温度下反应经过相同时间的转化率.下列叙述错误的是( )A、985℃时,H2S按上述反应分解的平衡常数K=
| ||
| B、H2S的分解为吸热反应 | ||
| C、图象能解释,温度升高,反应速率加快 | ||
| D、如果只将上述条件中的温度改为压强,图象的形式基本不变 |

A、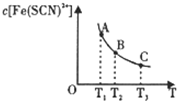 图是体系Fe3+(aq)+SCN-(aq)?Fe(SCN)2+(aq)中的c[Fe(SCN)2+]与温度T的平衡图象.A点与B点相比,A点的c(Fe3+)大 | B、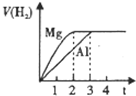 图表示镁和铝分别与等取度、等体积的过量稀硫酸反应,产生气体的体积V与时间t的关系.则犮应中镁和铝的反应速率之比为2:3 | C、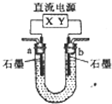 图表示电源X极为正极,U形管中为AgNO3溶液,则13管中电极反应式是:4OH--4e-═2H2O+O2↑ | D、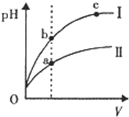 图是某温度下,相同体积,相同PH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积V变化的曲线.II为醋酸稀释时ph的变化曲线 |
(24分,每空3分)
(1)将4molSO2和2molO2充入2L的密闭容器中,在一定条件下发生反应,经10s后达到平衡,测得SO3的浓度为0.6mol·L-1,请回答下列问题:
①用O2表示的反应的平均速率为_____________________________________
②平衡时SO2的转化率______________________________________
③平衡时SO3的体积分数为___________________________
④10s时O2的浓度为_____________________________________________
(2)已知某可逆反应mA(g)+nB(g) ![]() qC(g)在密闭容器中进行。
qC(g)在密闭容器中进行。
如图所示反应在不同时间t,温度T和压强P与反应物B的体积
分数的关系曲线。根据图象填空
①化学计量数的关系:m+n______q;(填“>”.“<”或“=”)
②该反应的正反应为___________反应。(填“吸热”或“放热”)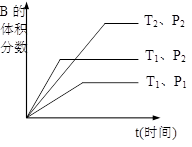
(3)在FeCl3+3KSCNFe(SCN)3+3KCl的平衡体系中,回答下列问题:
(填“正向”、“逆向”、“不”)
①在溶液中加入少量的KSCN固体,平衡 ______________移动。
②在溶液中加入少量的KCl固体,平衡 _____________移动。
(24分,每空3分)
(1)将4molSO2和2molO2充入2L的密闭容器中,在一定条件下发生反应,经10s后达到平衡,测得SO3 的浓度为0.6mol·L-1,请回答下列问题:
的浓度为0.6mol·L-1,请回答下列问题:
①用O2表示的反应的平均速率为___________________________ __________
__________
②平衡时SO2的转化率______________________________________
③平衡时SO3的体积分数为___________________________
④10s时O2的浓度为_____________________________________________
(2)已知某可逆反应mA(g)+nB(g)  qC(g)在密闭容器中进行。
qC(g)在密闭容器中进行。
如图所示反应在不同时间t,温度T和压强P与反应物B的体积
分数的关系曲线。根据图象填空
①化学计量数的关系:m+n______q;(填“ >”.“<”或“=”)
>”.“<”或“=”)
②该反应的正反应为___________反应。(填“吸热”或“放热”)
(3)在FeCl3+3KSCN Fe(SCN)3+3KCl的平衡体系中,回答下列问题:
Fe(SCN)3+3KCl的平衡体系中,回答下列问题:
(填“正向”、“逆向”、“不”)
①在溶液中加入少量的KSCN固体,平衡 ______________移动。
②在溶液中加入少量的KCl固体, 平衡 _____________移动。
平衡 _____________移动。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com