
题目列表(包括答案和解析)
反应时间t/h | 1 | 4 | 9 | 16 | 25 |
MgO层厚Y/nm | |||||
NiO层厚Y′/nm | b | 2b | 3b | 4b | 5b |
注:a和b均为与温度有关的常数。
(1)金属高温氧化腐蚀速率可用金属氧化膜的生长速率来表示,其理由是_______________。
(2)金属氧化膜的膜厚Y跟时间t所呈现的关系是_____________,_____________;MgO氧化膜膜厚Y属_____________型,NiO氧化膜膜厚Y′属_____________型(填“直线”或“抛物线”,“对数”或“双曲线”等类型)。
(3)Mg与Ni相比较,金属_________具有更良好的耐高温氧化腐蚀性,其理由是_____________________________________________________________________。
反应时间t/h | 1 | 4 | 9 | 16 | 25 |
MgO层厚Y/nm | |||||
NiO层厚Y′/nm | B | 2b | 3b | 4b | 5b |
注:a和b均为与温度有关的常数。
(1)金属高温氧化腐蚀速率可用金属氧化膜的生长速率来表示,其理由是_________________。
(2)金属氧化膜的膜厚Y和Y′跟时间t所呈现的关系是_______________,_______________;MgO氧化膜膜厚Y属_______________型,NiO氧化膜膜厚Y′属_______________型(填“直线”“抛物线”“对数”或“双曲线”等类型)。
(3)Mg与Ni相比较,金属_______________具有更良好的耐高温氧化腐蚀性,其理由是_____________________________________________________________________。
下表所列数据是在某高温下金属镁和镍分别在氧气中进行氧化反应时,在金属表面生成氧化薄膜的实验记录:
| 反应时间t/h | 1 | 4 | 9 | 16 | 25 |
| MgO层厚Y/nm | 0.05a | 0.20a | 0.45a | 0.80a | 1.25a |
| NiO层厚Y′/nm | b | 2b | 3b | 4b | 5b |
注:a和b均为与温度有关的常数。
(1)金属高温氧化腐蚀速率可用金属氧化膜的生长速率来表示,其理由是_______________。
(2)金属氧化膜的膜厚Y跟时间t所呈现的关系是_____________,_____________;MgO氧化膜膜厚Y属_____________型,NiO氧化膜膜厚Y′属_____________型(填“直线”或“抛物线”,“对数”或“双曲线”等类型)。
(3)Mg与Ni相比较,金属具_____________有更良好的耐高温氧化腐蚀性,其理由是______________________________________________________________________________。
下表所列数据是在某高温下金属镁和镍分别在氧气中进行氧化反应时,在金属表面生成氧化薄膜的实验记录:
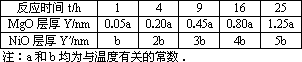
(1)金属高温氧化腐蚀速率可用金属氧化膜的生长速率来表示,其理由是_________________.
(2)金属氧化膜的膜厚Y跟时间t所呈现的关系是________,________;MgO氧化膜膜厚Y属________型,NiO氧化膜膜厚![]() 属________型(填“直线”或“抛物线”,“对数”或“双曲线”等类型).
属________型(填“直线”或“抛物线”,“对数”或“双曲线”等类型).
(3)Mg与Ni相比较,金属具________有更良好的耐高温氧化腐蚀性,其理由是_________________.
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.0 | 0.27 | 0.012 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com