
题目列表(包括答案和解析)
(16分)A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大。A原子核内无中子;A和E、D和F分别同主族,且B与D 最外层电子数之比为2:3。试回答下列问题:
(1)A元素的名称是 ,E元素在周期表中的位置是 ;
(2)C、D、F的气态氢化物稳定性由强到弱的顺序是 (填化学式);
(3)E单质在足量D单质中燃烧生成的化合物的电子式是 ;
(4)化合物X、Y均由A、D、E、F四种元素组成。
①X、Y均属于 化合物(填“离子”或“共价”);
②X与Y的水溶液相混合发生反应的离子方程式为 ;
(5)化合物E2F的水溶液中滴入双氧水和稀硫酸,加热,有单质生成。其离子反应方程式为: 。
(6)在A2D晶体中,每个分子与相邻的4个分子形成氢键,已知该晶体的升华热(晶体直接变成同温度气体时需要吸收的热量,叫做该晶体的升华热)是51 kJ/mol,除氢键外,分子间还存在范德华力(11 kJ/mol),则该晶体中氢键的“键能”是____kJ/mol;
【解析】原子核内无中子只有H,则A是氢元素。A和E,且E的原子序数大于B、C、D的,所以E只能是Na。B与D 最外层电子数之比为2:3,因为D的原子序数小于Na的所以D位于第二周期。若B与D 最外层电子数就是2和 3,则C就不能存在,所以B与D 最外层电子数就是4和6,即B是C,D是O,则C是N,F是S。
(1)略
(2)非金属性越强,氢化物的稳定性就越强,非金属性是O>N>S。
(3)钠的燃烧产物是过氧化钠,含有离子键和非极性键。
(4)钠是活泼的金属,所以由H、O、Na、S形成的化合物一定是离子化合物,它们分别为NaHSO4和NaHSO3。
(5)Na2S中S的化合价处于最低价态,具有还原性,而双氧水具有氧化性,二者分数氧化还原反应。
(6)每个水分子与相邻的4个分子形成氢键,则平均每个水分子形成的氢键是2个,所以氢键键能是![]() 。
。
(16分)A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大。A原子核内无中子;A和E、D和F分别同主族,且B与D 最外层电子数之比为2:3。试回答下列问题:
(1)A元素的名称是 ,E元素在周期表中的位置是 ;
(2)C、D、F的气态氢化物稳定性由强到弱的顺序是 (填化学式);
(3)E单质在足量D单质中燃烧生成的化合物的电子式是 ;
(4)化合物X、Y均由A、D、E、F四种元素组成。
①X、Y均属于 化合物(填“离子”或“共价”);
②X与Y的水溶液相混合发生反应的离子方程式为 ;
(5)化合物E2F的水溶液中滴入双氧水和稀硫酸,加热,有单质生成。其离子反应方程式为: 。
(6)在A2D晶体中,每个分子与相邻的4个分子形成氢键,已知该晶体的升华热(晶体直接变成同温度气体时需要吸收的热量,叫做该晶体的升华热)是51 kJ/mol,除氢键外,分子间还存在范德华力(11 kJ/mol),则该晶体中氢键的“键能”是____kJ/mol;
【解析】原子核内无中子只有H,则A是氢元素。A和E,且E的原子序数大于B、C、D的,所以E只能是Na。B与D 最外层电子数之比为2:3,因为D的原子序数小于Na的所以D位于第二周期。若B与D 最外层电子数就是2和 3,则C就不能存在,所以B与D 最外层电子数就是4和6,即B是C,D是O,则C是N,F是S。
(1)略
(2)非金属性越强,氢化物的稳定性就越强,非金属性是O>N>S。
(3)钠的燃烧产物是过氧化钠,含有离子键和非极性键。
(4)钠是活泼的金属,所以由H、O、Na、S形成的化合物一定是离子化合物,它们分别为NaHSO4和NaHSO3。
(5)Na2S中S的化合价处于最低价态,具有还原性,而双氧水具有氧化性,二者分数氧化还原反应。
(6)每个水分子与相邻的4个分子形成氢键,则平均每个水分子形成的氢键是2个,所以氢键键能是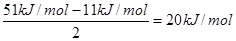 。
。
由下列三种元素构成的化合物中既有离子晶体,又有分子晶体的是
A、H、O、C B、Na、S、O
C、H、N、O D、H、S、O
由下列各组的三种元素构成的化合物中既有离子晶体,又有分子晶体的是( )
A.H、O、C B.Na、S、O C. H、N、O D.H、S、O
微量元素是指人体内总含量不到万分之一,重量总和不到人体重量的千分之一的20多种元素,这些元素对于人体的正常发育和健康起着重要作用,下列各组元素全部都是微量元素是( )
A.Na、K、Cl、S、O B.F、I、Fe、Zn、Cu
C.N、H、O、P、C D.Ge、Se、Cu、Mg、C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com