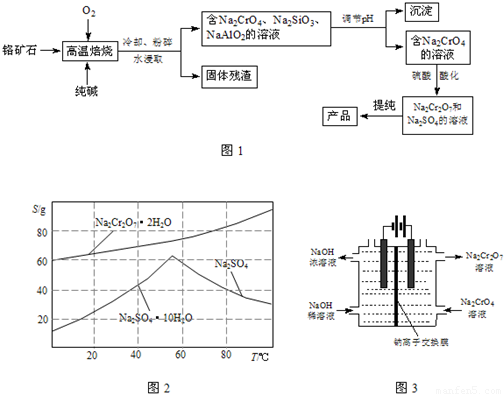
重铬酸钠(Na
2Cr
2O
7)广泛用作氧化剂、鞣革剂等.以铬矿石(主要成分为Cr
2O
3,还含有FeO、A1
2O
3、SiO
2等杂质)为原料制取重铬酸钠的流程如图1:
(1)Cr
2O
3在高温焙烧时反应的化学方程式为______.
(2)生产过程中,调节pH的目的是使SiO
32-、AlO
2-分别转化为______、______(填写化学式).
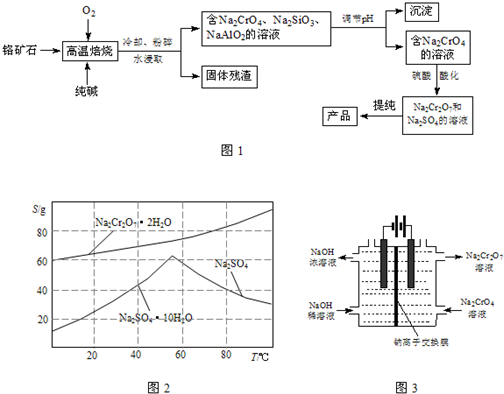
(3)图2是Na
2Cr
2O
7?2H
2O和Na
2SO
4的溶解度曲线:
上述提纯过程中,去除杂质Na
2SO
4的实验方法:将Na
2Cr
2O
7和Na
2SO
4混合溶液加热浓缩,然后______,可得到Na
2SO
4固体和较纯净的Na
2Cr
2O
7溶液.
(4)某化工厂改进工艺,采用原理如图3所示的装置(电极为石墨),通过电解提高阳极区溶液的酸性,实现Na
2CrO
4转化为Na
2Cr
2O
7.写出阳极的电极方程式______.
(5)根据国家标准,含CrO
42-的废水要经化学处理,使其浓度降至5.0×10
-7mol?L
-1以下才能排放.处理废水的常用方法为:向废水中加入可溶性钡盐生成BaCrO
4沉淀,再加入某种试剂处理多余的Ba
2+.[已知:K
sp(BaCrO
4)=1.2×10
-10]
①从物质分类的角度看,除去多余的Ba
2+离子,所加的试剂类型为______.
②加入可溶性钡盐后,废水中Ba
2+的浓度应不小于______.