
题目列表(包括答案和解析)
(12分)【化学一物质结构与性质】
已知A、B、C、D均为前四周期元素且原子序数依次增大,元素A的基态原子2p轨道有3个未成对电子,元素B的原子最外层电子数是其内层电子数的3倍,元素C的一种常见单质为淡黄色粉末,D的内层轨道全部排满电子,且最外层电子数为l。
(1)在第2周期中,第一电离能大于B的元素有____种。
(2)A的最简单气态氢化物分子的空间构型为________;H2B在乙醇中的溶解度大于H2C,其原因是_______。
(3)AB3,中,A原子轨道的杂化类型是_______ ,与AB3互为等电子体微粒的化学式
为________(写出一种即可)。
(4)D(OH)2难溶于水,易溶于氨水,写出其溶于氨水的离子方程
式_______.
( 5)D2B的晶胞如图所示,已知晶体的密度为 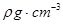 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则晶胞边长为_______cm(用含
,则晶胞边长为_______cm(用含  、
、 的式子表示)。
的式子表示)。
 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则晶胞边长为_______cm(用含
,则晶胞边长为_______cm(用含  、
、 的式子表示)。
的式子表示)。
[化学-物质结构与性质]
Ⅰ、为减少温室效应,科学家设计反应:CO2+4H2→CH4+2H2O以减小空气中CO2.
(1)若有1 mol CH4生成,则有________mol σ键和________mol π键断裂.
(2)CH4失去H-(氢负离子)形成CH+3(甲基正离子).已知CH+3的空间结构是平面正三角形,则CH+3中碳原子的杂化方式为________.
Ⅱ、金属原子与CO形成的配合物称为金属羰基配合物(如羰基铁).形成配合物时,每个CO提供一对电子与金属原子形成配位键,且金属原子的价电子和CO提供的电子总和等于18.
(3)金属羰基配合物中,微粒间作用力有________(填字母代号)
a、离子键
b、共价键
c、配位键
d、金属键
(4)羰基铁是一种黄色油状液体,熔点-21℃、沸点102.8℃.由此推测,固体羰基铁更接近于________(填晶体类型).若用Fe(CO)x表示羰基铁的化学式,则x=________.
Ⅲ.研究表明,对于中心离子为Hg2+等阳离子的配合物,若配位体给出电子能力越强:则配位体与中心离子形成的配位键就越强,配合物也就越稳定.
(5)预测HgCl42-与HgI42-的稳定性强弱,并从元素电负性的角度加以解释.
答:HgCl42-比HgI42-更________(填“稳定”或“不稳定”),因为________.
 物质结构与性质
物质结构与性质湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com