
题目列表(包括答案和解析)
设NA 代表阿伏加德罗常数的数值,下列说法正确的是
A.1 mol磷酸钾中阴离子所带电荷数为NA
B.在18 中含有
中含有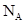 个18O原子
个18O原子
C.0.10mol Fe粉与足量水蒸气反应转移的电子数为0.30 NA
D.将0.1mol硅酸钠溶于1L水中,所得溶液中含有0.2NA个 Na+
NA代表阿伏加德罗常数,下列说法正确的是
A.1 L0.1
mol/L Na2CO3溶液中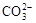 和HCO—3总数为0.1 NA
和HCO—3总数为0.1 NA
B.22.4L氢气和4g氦气均含有NA个分子
C.含2NA共价键的CnH2n+2分子的物质的量为2/(3n+l) mol
D.标准状况下,2.24LCl2与稀NaOH溶液反应,转移的电子总数为0.2NA
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的一种反应原理如下:
CH3OH(g) + H2O(g) → CO2(g) + 3H2(g) – 49.0 kJ
下列说法正确的是
A.1 LCH3OH蒸汽与1 L水蒸汽反应生成1 L CO2气体与3 L 氢气吸收热量49.0 kJ
B.1个CH3OH分子与1个水分子反应生成1个CO2分子与3个H2分子吸收49.0 kJ热量
C.相同条件下1molCH3OH(g)与1mol H2O(g)的能量总和小于1molCO2(g)与3 mol H2(g)的能量总和
D.1 molCH3OH蒸汽与1 mol液态水反应生成1mol CO2气体与3 mol 氢气吸收的热量小于49.0 kJ
下列说法正确的是
A.1 mol H2O的质量是18 g/mol
B.CH4的摩尔质量为16g
C.3.01×1023个SO2分子的质量是32 g
D.标准状况下,1 mol任何物质体积均为22.4 L
常温下,将等浓度的FeSO4和(NH4) 2SO4两种浓溶液混合可制得一种晶体,该晶体是分析化学中常用的一种还原剂,其强热分解反应化学方程式:2(NH4)2Fe(SO4)2·6H2O Fe2O3+2NH3↑+N2↑+4SO2↑+17H2O,下列说法正确的是
Fe2O3+2NH3↑+N2↑+4SO2↑+17H2O,下列说法正确的是
A.1 mol摩尔盐强热分解时转移电子的物质的量为8NA
B.该反应中氧化产物是N2、NH3,还原产物是SO2、Fe2O3
C.向摩尔盐溶液中滴入足量浓NaOH溶液,最终可得刺激性气体和白色沉淀
D.常温下,摩尔盐的溶解度比FeSO4、(NH4)2SO4小
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com