
题目列表(包括答案和解析)

①配制0.1 mol·L-1盐酸和0.1 mol·L-1 NaOH溶液;
②取一片此胃药片(药片质量均相等,每片为0.2g),磨碎后转移至锥形瓶中;
③以酚酞为指示剂,用0.1 mol·L-1 NaOH溶液滴定,用去Vx mL NaOH溶液时达到滴定终点;
④加入25 mL 0.1 mol·L-l盐酸。
(1)为使测定结果准确,至少需要滴定两次,得到的Vx值分别为Vl和V2。写出全部实验过程中,各步操作的正确顺序(填编号):_________。
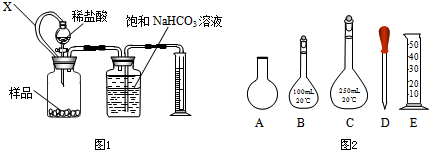
(2)图中所示仪器中,配制0.1 mol·L-1盐酸和0.1 mol·L-1 NaOH溶液肯定不需要的仪器是是________(填序号);配制上述溶液还需要用到的玻璃仪器是________(量取液体的仪器除外)________________(填仪器名称)。
(3)写出相关化学方程式:_________________________________________________________
____________________________________________________________________。
(4)每片胃药中含CaCO3的质量为________________g。
(10分)为测定某种胃药中CaCO3含量,化学兴趣小组同学设计了以下两种方案(药片 中的其它成分与盐酸和NaOH均不反应,请回答有关问题:
中的其它成分与盐酸和NaOH均不反应,请回答有关问题:
(1)方案一:用右侧装置测量一定量样品与足量稀盐酸反应生成CO2的体积计算CaCO3的含量;装置中连通管X的作用是 。
(2)方案二:用滴定法测定,有以下几步操作:
A.配制0.1mol/LHC1溶液和0.100 mol/LNaOH溶液
B.取一粒药片(0. 100g),研碎后加入20mL蒸馏水
C.以酚酞为指示剂,用0.100 mol/LNaOH溶液滴定,用去体积为VmL达到终点
D.用酸式滴定管加入25ml 0.1mol/LHC1溶液,充分反应
 ①滴定过程的正确操作顺序为 (填字母)。
①滴定过程的正确操作顺序为 (填字母)。
滴定终点的判断依据是 。
②若需重复滴定4次,配制0.1mol/LHC1溶液需选用右图所示仪器中的 (填字母)。
③经测定,每次消耗NaOH溶液体积的平均值为13.00ml,则该胃药中CaCO3的质量分数为 ,
④与方案一相比,方案二的主要优点是:除了滴定法所需样品和试剂量少之外,还有 。

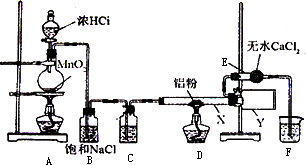
Ⅰ无水氯化铝是某些有机化学反应中常用的催化剂,它的熔点190℃,但在180℃时已开始升华.它在常温下是一种白色固体,遇水发生剧烈的水解反应,甚至在空气中遇到微量水汽也强烈地发烟.用下列装置制取无水氯化铝:
回答以下问题:
(1)装置D中发生的化学反应方程式:________.
(2)仪器X与仪器Y直接相连的意图是:
①收集产物
②________.
(3)能否去掉E装置________原因是________.
(4)实验时应先点燃________处的酒精灯,其作用是________.
Ⅱ.某种胃药中止酸剂为CaCO3.为测定其中CaCO3的含量,某化学小组设计了以下方案(药片中的其他成分与HCl和NaOH溶液均不反应):
用滴定法测定,有以下几步操作:
A.配制0.100 mol/L HCl溶液和0.100 mol/L NaOH溶液
B.取一粒药片(0.100 g),研碎后加入20.0 mL蒸馏水
C.以酚酞为指示剂用0.100 mol/L NaOH溶液滴定,用去NaOH溶液VmL时达到终点
D.用酸式滴定管加入25.00 mL 0.100 mol/L HCl溶液,充分反应
请回答有关问题:
(1)测定过程的正确操作顺序为________(填字母).
(2)经测定,每次消耗NaOH溶液体积的平均值为13.00 mL,则该胃药中CaCO3的质量分数是________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com