Ⅰ以下是有关SO
2、Cl
2的性质实验.
(1)某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究SO
2和Cl
2的性质.
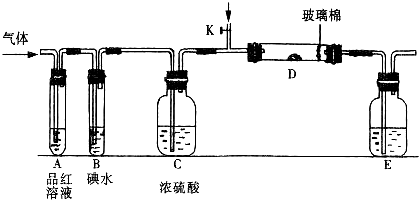
①若从左端分别通入SO
2和Cl
2,装置A中观察到的现象是否相同?
相同
相同
(填“相同”或“不相同”);若装置D中装的是V
2O
5(催化剂),通入SO
2时,打开K通入适量O
2的化学反应方程式为
.
②SO
2通入B中,溶液颜色退去,则该反应的离子方程式为
SO2+I2+2H2O=4H++2I-+SO42-
SO2+I2+2H2O=4H++2I-+SO42-
.
(2)某同学将足量的SO
2通入一支装有氯化钡溶液的试管,未见沉淀生成,若向该试管中加入足量(填字母)
B
B
,仍然无法观察到沉淀产生.
A.氨水;B.稀盐酸;C.硝酸钾溶液;D.硫化钠溶液
(3)若由元素S和O组成-2价酸根离子X,X中S和O的质量比为2:3;当Cl
2与含X的溶液完全反应后,得澄清溶液,取少量该溶液加入盐酸酸化的氯化钡溶液,有白色沉淀产生.写出Cl
2与含X的溶液反应的离子方程式
Cl2+SO32-+H2O=SO42-+2Cl-+2H+
Cl2+SO32-+H2O=SO42-+2Cl-+2H+
.
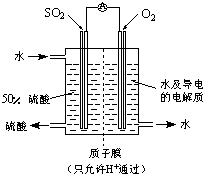
(4)某科研单位利用电化学原理用SO
2来制备硫酸,装置如下图,含有某种催化剂,电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触.通入SO
2的电极为
负
负
极,其电极反应式为
SO2-2e-+2H2O=4H++SO42-
SO2-2e-+2H2O=4H++SO42-
;电池的总反应式
2SO2+O2+2H2O=2H2SO4
2SO2+O2+2H2O=2H2SO4
Ⅱ实验是化学研究的基础,关于下列各装置图的叙述正确的是
C
C
(填序号)
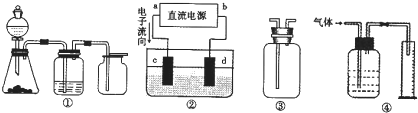
A.装置①可完成多种气体的发生、净化和收集,如铜屑与稀硝酸反应
B.装置②中,a为正极,d为阳极
C.装置③可用于收集H
2、NH
3、Cl
2,、HCl、NO
2等
D.装置④能用于测量气体体积
Ⅲ用铅蓄电池电解苦卤水(含Cl
-、Br
-、Na
+、Mg
2+)的装置如图所示(a、b为石墨电极).下列说法中正确的是
D
D
(填序号)
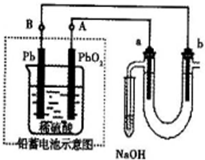
A.铅蓄电池负极的反应式为:Pb-2e
-=Pb
2+B.铅蓄电池放电时,B极质量减轻,A极质量增加
C.铅蓄电池充电时,A极应与外电源负极相连
D.电解苦卤水时,a电极首先放电的是Br
-.




