
题目列表(包括答案和解析)
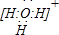




| ||
| ||
| ||
| ||
A、B、C、D、E、F、G、H八种元素分布在三个不同的短周期,它们的原子序数依次增大,其中B、C、D为同一周期,A与E,B与G,D与H分别为同一主族,C和D的最外层电子数之和为11,C、D、F三种元素的原子序数之和为28。请回答下列问题:
(1)B与D可形成非极性分子X,过量的X与F D2-溶液反应的离子方程式为____________________________。
(2)E、F、H所形成的简单离子的半径由大到小的顺序为(用离子符号表示) 。
(3)G的最高价氧化物与B的单质在高温下能发生置换反应,其化学反应方程式为:
。
(4)盐Y由B、D、E组成。以熔融盐Y为电解质构成的燃料电池如右图所示。写出石墨(I)电极上发生的电极反应式: 。

(5)用熔融盐Y的燃料电池作电源,以石墨为电极,电解一定浓度的CuSO4溶液至无色后继续电解一段时间。断开电路,向溶液中加入0.1 mol Cu(OH)2,溶液恢复到电解之前的体积和浓度,则电解过程中转移电子的物质的量为______。
(6)由A、C、D、E四种元素中任意三种构成的强电解质Z和W,溶于水时都能促进水的电离,测得Z的水溶液pH>7,W的水溶液pH<7,则Z为 、W为 。
(7)在一个装有可移动活塞的容器中进行如下反应:C2(g)+3A2(g)![]() 2CA3(g),反应达到平衡后,测得容器中含有C2 0.5mol,A20.2mol,CA30.2mol,总容积为1.0L。
2CA3(g),反应达到平衡后,测得容器中含有C2 0.5mol,A20.2mol,CA30.2mol,总容积为1.0L。
①如果达成此平衡前各物质起始的量有以下几种可能,其中不合理的是________:
A.C2 0.6mol, A2 0.5mol, CA30mol
B.C2 0mol, A2 0mol, CA3 1.2mol
C.C2 0.6mol/L,A2 0.5mol/L, CA3 0.1mol/L
②求算此平衡体系的平衡常数K=________;
A、B、C、D、E均为中学化学常见的10电子粒子。已知,M(A)>M(B),
C是一种重要的化工原料。下图表示在1L的密闭容器中,一定条件下X、Y、C三种气体因发生反应而导致的物质的量随时间的变化情况。
回答下列问题。
(1)写出B的电子式 。
(2)写出FG的离子方程式 。
(3)根据题图写出相关的化学方程式 。(用化学式表示)
(4)下表为一定条件下平衡混合物中C的体积分数(C%)。分析数据可知,表中a的取值范围是 。
(5)根据题图和题表分析,25 min ~ 40 min内曲线发生变化的原因可能是 (填选项代号,下同);50 min ~ 65 min曲线发生变化的原因可能是 。
A.降低温度 B.增加C的物质的量 C.加了催化剂 D.缩小容器体积
(6)工业上合成C的温度一般选择在500℃左右,主要原因是 。
(14分).电炉加热时用纯氧气氧化管内样品,根据产物的质量确定有机物的组成,下列装置是用燃烧法确定有机物分子式常用的装置(E中电炉省去)。
(1)产生的氧气按从左到右的流向,所选装置各导管的连接顺序是__________________(3分)。
(2)C装置中浓H2SO4的作用是__________________。
(3)D装置中MnO2的作用是____________________。
(4)E燃烧管中CuO的作用是______________________。
(5)若准确称取0.90 g样品(只含C、H、O三种元素中的两种或三种),经充分燃烧后,A管质量增加1.32 g,B管质量增加0.54 g,则该有机物的最简式为_____________________(3分)。
(6)要确立该有机物的分子式,还要知道________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com