
题目列表(包括答案和解析)
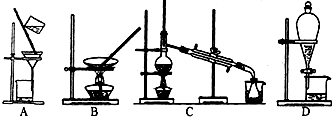
甲、乙的实验装置如图所示,丙、丁分别是氯碱工业生产示意图和制备金属钛的示意图。
请回答下列问题:
(1)写出甲装置中碳棒表面的电极反应式:_______________________________。
(2)已知:5Cl2+I2+6H2O=10HCl+2HIO3。若将湿润的淀粉KI试纸置于乙装置中的碳棒附近,现象为________________________________;若乙装置中转移0.02 mol电子后停止实验,烧杯中溶液的体积为200 mL,则此时溶液的pH=________。(室温条件下,且不考虑电解产物的相互反应)
(3)工业上经常用到离子交换膜,离子交换膜有阳离子交换膜和阴离子交换膜两种,阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过。当乙装置中的反应用于工业生产时,为了阻止两极产物之间的反应,通常用如丙图所示的装置,Na+的移动方向如图中标注,则H2的出口是________(填“C”、“D”、“E”或“F”);________(填“能”或“不能”)将阳离子交换膜换成阴离子交换膜。
(4)研究发现,可以用石墨作阳极、钛网作阴极、熔融CaO作电解质,利用丁装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛。
①写出阳极的电极反应式:___________________________________________。
②在制备金属钛前后,CaO的总量不变,其原因是(请结合化学用语解释)__________________________________________________________。
③电解过程中需定期更换阳极材料的原因是____________________________。
元素铝是在生产、生活中应用广泛的金属元素。
(1)从矿石提取氧化铝:矿石与NaOH溶液高温反应,然后降温析出晶体,再经净化和高温煅烧得到氧化铝。降温析出晶体时的反应方程式为: 。

(2)氧化铝是工业电解冶炼铝的重要原料,生产中加入冰晶石(Na3AlF6),其作用是 。
工业冶炼铝的装置示意图如右:
①阴极的反应式 ,
②在电解池工作过程中,需要不断补充阳极材料,原因是 。
(3)有资料介绍:溶液中铝元素以氢氧化物[用Al(OH)3表示]形式存在的pH范围是3.8~10。现有A、B两种均含铝元素形成的某种离子溶液,其pH分别为1、13,两溶液等体积混合时反应的离子方程式为 。
(4)一种新型高效净水剂PAFC——聚合氯化铁铝[A1Fe(OH)nCl6-n]m,广泛用于日常生活用水和工业污水的处理。有关PAFC的说法正确的是 。(填选项)
A.PAFC中铁元素显+2价
B.PAFC用于净水时,比用相同量的氯化铝和氯化铁对水的pH改变小
C.PAFC可看作一定比例的氯化铁与氯化铝水解的中间产物
D.PAFC在强酸性和强碱性溶液中都能稳定存在
元素铝是在生产、生活中应用广泛的金属元素。
(1)从矿石提取氧化铝:矿石与NaOH溶液高温反应,然后降温析出晶体,再经净化和高温煅烧得到氧化铝。降温析出晶体时的反应方程式为: 。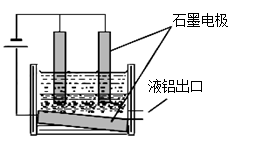
(2)氧化铝是工业电解冶炼铝的重要原料,生产中加入冰晶石(Na3AlF6),其作用是 。
工业冶炼铝的装置示意图如右:
①阴极的反应式 ,
②在电解池工作过程中,需要不断补充阳极材料,原因是 。
(3)有资料介绍:溶液中铝元素以氢氧化物[用Al(OH)3表示]形式存在的pH范围是3.8~10。现有A、B两种均含铝元素形成的某种离子溶液,其pH分别为1、13,两溶液等体积混合时反应的离子方程式为 。
(4)一种新型高效净水剂PAFC——聚合氯化铁铝[A1Fe(OH)nCl6-n]m,广泛用于日常生活用水和工业污水的处理。有关PAFC的说法正确的是 。(填选项)
A.PAFC中铁元素显+2价
B.PAFC用于净水时,比用相同量的氯化铝和氯化铁对水的pH改变小
C.PAFC可看作一定比例的氯化铁与氯化铝水解的中间产物
D.PAFC在强酸性和强碱性溶液中都能稳定存在
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com