(2011?南京三模)随着氮氧化物污染的日趋严重,国家将于“十二五”期间加大对氮氧化物排放的控制力度. 目前,消除氮氧化物污染有多种方法.
(1)用活性炭还原法处理氮氧化物.有关反应为:C(s)+2NO(g)?N
2 (g)+CO
2 (g)△H.某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T
1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
浓度/mol?L-1
/
时间/min |
NO |
N2 |
CO2 |
| 0 |
0.100 |
0 |
0 |
| 10 |
0.058 |
0.021 |
0.021 |
| 20 |
0.040 |
0.030 |
0.030 |
| 30 |
0.040 |
0.030 |
0.030 |
| 40 |
0.032 |
0.034 |
0.017 |
| 50 |
0.032 |
0.034 |
0.017 |
①T
1℃时,该反应的平衡常数K=
0.56
0.56
(保留两位小数).
②30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是
减小CO2的浓度
减小CO2的浓度
.
③若30min后升高温度至T
2℃,达到平衡时,容器中NO、N
2、CO
2的浓度之比为5:3:3,则该反应的△H
<
<
0(填“>”、“=”或“<”).
(2)用CH
4催化还原氮氧化物可以消除氮氧化物的污染.已知:
①CH
4(g)+4NO
2(g)=4NO(g)+CO
2(g)+2H
2O(g)△H=-574kJ?mol
-1②CH
4(g)+4NO(g)=2N
2(g)+CO
2(g)+2H
2O(g)△H=-1160kJ?mol
-1③H
2O(g)=H
2O(l)△H=-44.0kJ?mol
-1写出CH
4(g)与NO
2(g)反应生成N
2 (g)、CO
2 (g)和H
2O(1)的热化学方程式
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l)△H=-955 kJ?mol-1
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l)△H=-955 kJ?mol-1
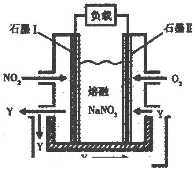
(3)以NO
2、O
2、熔融NaNO
3组成的燃料电池装置如下图所示,在使用过程中石墨I电极反应生成一种氧化物Y,有关电极反应
可表示为
NO2+NO3--e-=N2O5
NO2+NO3--e-=N2O5
.

 二甲基亚砜
二甲基亚砜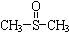 有消炎止痛、镇静等作用.甲醇和硫化氢在γ-Al2O3催化剂作用下生成甲硫醚(CH3-S-CH3),甲硫醚再与NO2反应制取二甲基亚砜(
有消炎止痛、镇静等作用.甲醇和硫化氢在γ-Al2O3催化剂作用下生成甲硫醚(CH3-S-CH3),甲硫醚再与NO2反应制取二甲基亚砜( ),有关反应如下:
),有关反应如下:
