(2012?江苏一模)镁及其合金广泛应用于航空航天、交通、电池等行业,金属镁的制备方法主要有:
①电解无水氯化镁法,②碳或碳化钙热还原法,③皮江法.
已知:
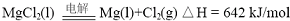
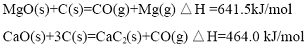
(1)写出MgO(s)与CaC
2(s)作用生成Mg(g)及CaO(s)及C(s)的热化学方程式:
CaC2(s)+MgO(s)=CaO(s)+Mg(g)+2C(s),△H=(641.5-464.0)kJ/mol=177.5kJ/mol
CaC2(s)+MgO(s)=CaO(s)+Mg(g)+2C(s),△H=(641.5-464.0)kJ/mol=177.5kJ/mol
.
(2)碳化钙还原氧化镁的文献资料如表2
表2 还原剂的用量与温度、保温时间计MgO还原率
| n(CaC2)/N(MgO) |
还原温度/℃ |
恒温时间/h |
还原率/% |
| 1.1 |
1110 |
2.0 |
62 |
| 1.1 |
1150 |
2.0 |
80 |
| 1.1 |
1150 |
2.5 |
85 |
| 1.2 |
1000 |
2.0 |
33 |
| 1.2 |
1150 |
2.0 |
84 |
| 1.2 |
1150 |
2.5 |
88 |
| 1.3 |
1150 |
2.0 |
86 |
| 1.3 |
1150 |
2.0 |
88 |
实际生产中只采取恒温2h,其主要原因是:
相同条件下延长保温时间时,还原率增加不明显,生成成本增大
相同条件下延长保温时间时,还原率增加不明显,生成成本增大
;采用n(CaC
2)/n(MgO)配比为1.2,而不是1.3,其主要原因是:
相同条件下,还原剂配比由1.2升高到1.3,还原剂用量增大,还原率增加不明显,生产成本增大
相同条件下,还原剂配比由1.2升高到1.3,还原剂用量增大,还原率增加不明显,生产成本增大
.
(3)用电解法制取镁时,若原料氯化镁含有水时,在电解温度下,原料会形成Mg(OH)Cl,并发生电离反应:Mg(OH)Cl=Mg(OH)
++Cl
-.电解时在阴极表面会产生氧化镁钝化膜,此时阴极的反应式为
2Mg(OH)++2e-=MgO+H2↑
2Mg(OH)++2e-=MgO+H2↑
.实验室由MgCl
2?6H
2O制取无水氯化镁可采用的方法是
在氯化氢气流中加热脱水
在氯化氢气流中加热脱水
.
(4)我国目前生产金属镁主要用皮江法生产,其原料为白云石(MgCO
3?CaCO
3)的煅烧产物和硅铁(含75%Si).其生产原理为:
2CaO+2MgO(s)+Si(s)
2Mg(g)+Ca
2SiO
4(s),采用真空操作除了能降低操作温度外,还具有的优点是
防止硅和镁被氧化,并提高金属镁的产率
防止硅和镁被氧化,并提高金属镁的产率
.
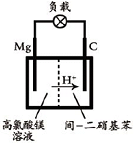
(5)镁/间-二硝基苯电池的装置如图所示,电池工作时镁转变为氢氧化镁,间-二硝基苯则转变为间-二苯胺.该电池正极的电极反应式为
.


 (2012?江苏一模)镁及其合金广泛应用于航空航天、交通、电池等行业,金属镁的制备方法主要有:
(2012?江苏一模)镁及其合金广泛应用于航空航天、交通、电池等行业,金属镁的制备方法主要有:
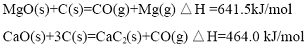


 (2010?江苏)下列有关实验原理或操作正确的是( )
(2010?江苏)下列有关实验原理或操作正确的是( )