
题目列表(包括答案和解析)
(09江苏高考化学)下列离子方程式与所述事实相符且正确的是:
A.漂白粉溶液在空气中失效:CIO-+CO2+H2O=HClO+HCO3-
B.用浓盐酸与MnO2 反应制取少量氯气:MnO2+2H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
C.向NaAlO2 溶液中通入过量的CO2 制取Al(OH)3:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
D.在强碱溶液中,次氯酸钠与Fe(OH)3反应生成Na2FeO4:
3ClO-+2Fe(OH)3=2FeO42-+3Cl-+H2O+4H+
(09江苏高考化学)在下列各溶液中,离子一定能大量共存的是:
A.强碱性溶液中:K+、Al3+、Cl-、SO42-
B.含有0.1mol·L-1Fe3+的溶液中:K+、Mg2+、I-、NO3-
C.含有0.1mol·L-1Ca2+的溶液中:Na+、K+、CO32-、Cl-
D.室温下,pH=1的溶液中:Na+、Fe3+、NO3-、SO42-
(09江苏高考化学)下列化学实验事实及其解释都正确的是:
A.向碘水中滴加CCl4,振荡静置后分层,CCl4层呈紫红色,说明可用CCl4从碘水中萃取碘
B.向SO2 水溶液中滴加盐酸酸化的BaCl2 溶液,有白色沉淀生成,说明BaSO4 难溶于盐酸
C.向0.1mol·L-1 FeSO4 溶液中滴加少量酸性KMnO4 溶液,KMnO4 溶液褪色,说明Fe2+具有氧化性
D.向2.0mL浓度均为0.1mol·L-1 的KCl、KI混合溶液中滴加1~2滴0.01mol·L-1 AgNO3 溶液, 振荡,沉淀呈黄色,说明AgCl 的Ksp比AgI 的Ksp大
(09江苏高考化学)医用氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含有少量Na+、Al3+、Fe3+等杂质)生产医药级二水合氯化钙(CaCl2·2H2O的质量分数为97.0%~103.0%)的主要流程如下:
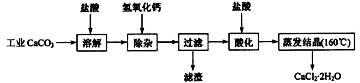 |
(1)除杂操作是加入氢氧化钙,调节溶液的pH为8.0~8.5,以除去溶液中的少量 Al3+、Fe3+。检验Fe(OH)3是否沉淀完全的实验操作是 。
(2)酸化操作是加入盐酸,调节溶液的pH为4.0,其目的有:①将溶液中的少量 Ca(OH)2 转化为CaCl2;②防止Ca2+在蒸发时水解;③ 。
(3)测定样品中Cl-含量的方法是:a.称取0.7500g样品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测液于锥形瓶中;c.用0.05000mol·L-1 AgNO3 溶液滴定至终点,消耗AgNO3 溶液体积的平均值为20.39mL。①上述测定过程中需用溶液润洗的仪器有: 。②计算上述样品中CaCl2·2H2O的质量分数为: 。③若用上述方法测定的样品中CaCl2·2H2O的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有: ; 。
(09江苏高考化学)(10分)联氨(N2H4)及其衍生物是一类重要的火箭燃料,N2H4与N2O4能放出大量的热。
(1)已知:2NO2(g)=N2O4(g) △H=-57.20kJ·mol-1。一定温度下,在密闭容器中反应2NO2(g)=N2O4(g) 达到平衡。其它条件不变时,下列措施能提高NO2转化率的是 (填字母)。
A.减小NO2的浓度 B.降低温度C.增加NO2的浓度 D.升高温度
(2)25℃时,1.00gN2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O (l) ,放出19.14kJ
的热量。则反应2N2H4(l)+N2O4(l)=3N2(g)+4H2O (l)的△H= kJ·mol-1
(3)17℃、1.01×105Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.0300mol·L-1、c(N2O4)=0.0120mol·L-1。计算反应2 NO2(g)![]() N2O4(g)的平衡常数K。
N2O4(g)的平衡常数K。
(4)现用一定量的Cu 与足量的浓HNO3 反应,制得1.00L已达平衡的N2O4和NO2 混合气体(17℃、1.01×105Pa),理论上至少需消耗Cu 多少克?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com