硫酸亚铁铵晶体[(NH
4)
2SO
4?FeSO
4?6H
2O]是一种重要化学试剂,实验室用除去锌镀层的铁片来制取硫酸亚铁铵,流程如下:
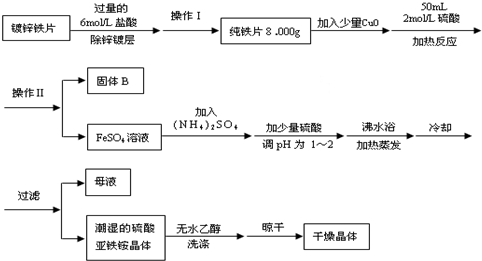
请回答下列问题:
(1)确定锌镀层被除去的标志是
.
计算上述铁片锌镀层的厚度,不需要的数据是
(填编号).
a.锌的密度ρ(g?cm
-3) b.镀锌铁片质量m
1(g) c.纯铁片质量m
2(g)
d.镀锌铁片面积S(cm
2) e.镀锌铁片厚度h(cm)
(2)上述流程中:操作Ⅰ是取出铁片、
、烘干、称量.加入少量CuO的目的是
.
(3)用无水乙醇洗涤潮湿的硫酸亚铁铵晶体是为了除去晶体表面残留的水分,不用加热烘干的原因是
.
(4)鉴定所得晶体中含有Fe
2+、NH
4+、SO
42-离子的实验方法不正确的是
(填编号).
a.取少量样品于试管,加水溶解,通入适量Cl
2,再加KSCN溶液,观察现象
b.取少量样品于试管,加水溶解,加入NaOH溶液,露置于空气中,观察现象
c.取少量样品于试管,加水溶解,加入浓NaOH溶液并加热,用湿润的红色石蕊试纸置于试管口,观察试纸颜色的变化
d.取少量样品于试管,加水溶解,加入盐酸后再加入BaCl
2溶液,观察现象
(5)取a克样品配成500ml溶液,取25.00mL先用稀硫酸酸化,再用bmol?L
-1的酸性重铬酸钾(K
2Cr
2O
7)溶液滴定,消耗重铬酸钾溶液VmL(已知重铬酸钾的还原产物为Cr
3+离子),请写出重铬酸钾溶液与Fe
2+离子反应的离子方程式
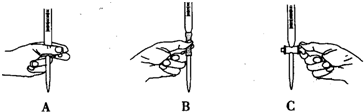
.用酸性重铬酸钾溶液滴定Fe
2+过程中操作滴定管的图示正确的是
.
用题中所给数据计算所得样品中铁元素的质量分数为
.


