
题目列表(包括答案和解析)
为了检验某含有NaHCO3杂质的Na2CO3样品的纯度,现将w1 g样品加热,其质量变为w2 g,,则该样品Na2CO3的纯度(质量分数)是
A.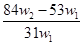 B.
B. C.
C. D.
D.
为了检验某含有NaHCO3杂质的Na2CO3样品的纯度,现将w1 g 样品加热,其质量变为w2 g ,则该样品的纯度(质量分数)是
![]() A.
A. ![]() B.
B.![]() C.
C. ![]() D.
D.![]()
为了检验某含有NaHCO3杂质的Na2CO3样品的纯度,现将w1 g样品加热,其质量变为w2 g,则该样品的纯度(质量分数)是
A. | B.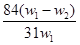 |
C. | D. |
为了检验某含有NaHCO3杂质的Na2CO3样品的纯度,现将w1 g样品加热,其质量变为w2 g,则该样品的纯度(质量分数)是 ( )
A.![]() B.
B.![]()
C.![]() D.
D.![]()
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com