
题目列表(包括答案和解析)
| 水浴 |
| 水浴 |
①燃料电池中两极上进行的电极反应分别为
a.正极_____________________________________________;
b.负极_____________________________________________。
②电解池中两极上进行的电极反应分别为
a.阴极_____________________________________________;
b.阳极_____________________________________________。
(2)将(1)中的“氢氧化钠溶液”改为“硫酸溶液,”其他同(1),试写出答案。
(3)若燃料电池中电解质溶液为氢氧化钠溶液,但向负极通入的气体不是氢气,而是一氧化碳(或甲烷,或乙烯,或乙炔),则原电池中两极上进行的电极反应、电池总反应和电解质溶液pH的变化分别是:
当通入一氧化碳时:
a.正极_____________________________________________;
b.负极_____________________________________________;
c.电池总反应为_____________________________________;
d.电解质溶液pH的变化为_________。(填“增大”“减小”或“不变”)
(10分)下图是一个电化学过程的示意图。
请回答下列问题:
(1)图中甲池的名称 (填“原电池”“电解池”或“电镀池”)。
(2)写出通入CH3OH的电极的电极反应式: 。
(3)乙池中反应的化学方程式为 ,当乙池中B极的质量增加5.4g时,甲池中理论上消耗O2的体积为 L(标准状况下),此时丙池中 电极(填“C”或“D”)析出1.6g某金属,则丙池的某盐溶液可能是 (填序号)
A.MgSO4溶液 B.CuSO4溶液 C.NaCl溶液 D.AgNO3溶液
【解析】(1)甲属于燃料电池,给乙池和丙池供电。在燃料电池中可燃物在负极通入,所以电极反应式为CH3OH+8OH――6e-=CO32-+6H2O。电极A和电池的正极相连,所以A是阳极、B是阴极、C是阳极、D是阴极。A是惰性电极,所以乙池中反应式为4AgNO3+2H2O 4Ag+O2↑+4HNO3。5.4g是单质银,转移的电子是
![]() ,所以根据得失电子守恒可知氧气的物质的量是
,所以根据得失电子守恒可知氧气的物质的量是![]() 。金属阳离子只有在阴极放电,所以在D电极放电。镁和钠属于活泼的金属,在水溶液中其离子不可能放电。1.6g若是铜,则转移的电子为
。金属阳离子只有在阴极放电,所以在D电极放电。镁和钠属于活泼的金属,在水溶液中其离子不可能放电。1.6g若是铜,则转移的电子为![]() ,正确。若是银,则说明硝酸银不足,还有氢气生成,所以答案是BD。
,正确。若是银,则说明硝酸银不足,还有氢气生成,所以答案是BD。
(10分)下图是一个电化学过程的示意图。

请回答下列问题:
(1)图中甲池的名称 (填“原电池”“电解池”或“电镀池”)。
(2)写出通入CH3OH的电极的电极反应式: 。
(3)乙池中反应的化学方程式为 ,当乙池中B极的质量增加5.4g时,甲池中理论上消耗O2的体积为 L(标准状况下),此时丙池中 电极(填“C”或“D”)析出1.6g某金属,则丙池的某盐溶液可能是 (填序号)
A.MgSO4溶液 B.CuSO4溶液 C.NaCl溶液 D.AgNO3溶液
【解析】(1)甲属于燃料电池,给乙池和丙池供电。在燃料电池中可燃物在负极通入,所以电极反应式为CH3OH+8OH――6e-=CO32-+6H2O。电极A和电池的正极相连,所以A是阳极、B是阴极、C是阳极、D是阴极。A是惰性电极,所以乙池中反应式为4AgNO3+2H2O
 4Ag+O2↑+4HNO3。5.4g是单质银,转移的电子是
4Ag+O2↑+4HNO3。5.4g是单质银,转移的电子是 ,所以根据得失电子守恒可知氧气的物质的量是
,所以根据得失电子守恒可知氧气的物质的量是 。金属阳离子只有在阴极放电,所以在D电极放电。镁和钠属于活泼的金属,在水溶液中其离子不可能放电。1.6g若是铜,则转移的电子为
。金属阳离子只有在阴极放电,所以在D电极放电。镁和钠属于活泼的金属,在水溶液中其离子不可能放电。1.6g若是铜,则转移的电子为 ,正确。若是银,则说明硝酸银不足,还有氢气生成,所以答案是BD。
,正确。若是银,则说明硝酸银不足,还有氢气生成,所以答案是BD。
某高二化学兴趣小组为了探究铝电极在原电池中的作用,设计并进行了以下一系列实验,实验结果记录如表:
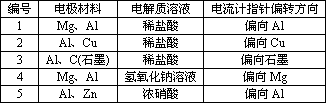
试根据表中的实验现象回答下列问题:
(1)实验1、2中Al所作的电极(正极或负极)是否相同(填“是”或“否”)答案:________.
(2)对实验3完成下列填空:
①铝为________极,电极反应式:________.
②石墨为________,电极反应式:________.
③电池总反应方程式:________.
(3)实验4中铝作负极还是正极________,理由是________.写出铝电极的电极反应式________.
(4)解释实验5中电流计指针偏向铝的原因:________.
(5)根据实验结果总结出影响铝在原电池中作正极或负极的因素:________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com