
题目列表(包括答案和解析)
 Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据如下表:
Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据如下表:| 元素 | Mn | Fe | |
电离能(kJ/mol) |
I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
| 元 素 | Mn | Fe | |
| 电离能 /kJ·mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 |
回答下列问题:
⑴亚铁离子价电子层的电子排布式为
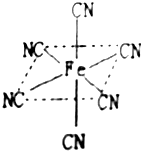
⑵ Fe原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物。
①与Fe原子或离子形成配合物的分子或离子应具备的结构特征是 ;
② 六氰合亚铁离子(Fe(CN)64-)中的配体CN-中C原子的杂化轨道类型是 ,写出一种与CN-互为等电子体的单质分子的电子式 ;
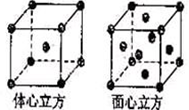
⑶ 金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如右图所示。体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为 。
(10分)Mn、Fe均为第四周期过渡元素,两元素的部分电离能(I)数据列于下表:
| 元素 | 25Mn | 26Fe | |
| 电离能/kJ·mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
| 元 素 | Mn | Fe | |
| 电离能 /kJ·mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
 与Fe原子或离子形成配合物的分子或离子应具备的结构特征是 ;
与Fe原子或离子形成配合物的分子或离子应具备的结构特征是 ;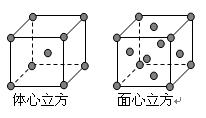
Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:

回答下列问题:
(1)Mn元素价电子的电子排布式为??????????????????????? ,比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fen再失去一个电子难。其原因是??????????????? 。
(2)Fe原子或离子外围有较多能量相近的空轨道能与一些分子或离子形成配合物。
①与Fe原子或离子形成配合物的分子或离子应具备的结构特征是???????????? 。
②络离子[Fe(CN)6]4-的配体CN-中C原子的杂化轨道类型是??????????? ,写出一种与 CN-互为等电子体的单质分子的电子式?????????????????????????? 。
(3)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上升华。易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁的晶体类型为???????????????? 。
(4)金属铁晶体在不同的温度下有两种堆积方式,如图所示。体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为????????????? 。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com