
题目列表(包括答案和解析)
如图,A~D四种物质均含有同一种元素,A是非金属单质,D是最高价氧化物对应的水化物,则A、B、C、D中共同含有的元素可能是 ( )
①C ②N ③Si ④S ⑤Cl
A.①② B.②⑤ C.③④ D.②④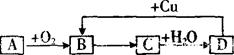
如图,A~D四种物质均含有同一种元素,A是非金属单质,D是最高价氧化物对应的水化物,则A、B、C、D中共同含有的元素可能是 ( )
①C ②N ③Si ④S ⑤Cl
A.①② B.②⑤ C.③④ D.②④

| A、是非极性分子 | B、分子呈平面正三角形 | C、3个S、O键都是单键 | D、聚合时放出热量 |
|
下列说法中正确的是 | |
| [ ] | |
A. |
BF3、NF3分子的价层电子对互斥模型均为平面正三角形 |
B. |
H-Cl的键能为431.8 kJ·mol-1,H-I的键能为298.7 kJ·mol-1,这可以说明HCl分子比HI分子稳定 |
C. |
可燃冰是甲烷的结晶水合物,甲烷可与水形成氢键 |
D. |
因为N-H键能比P-H大,所以NH3沸点比PH3高 |
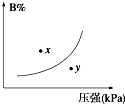 反应mA(s)+nB(g)?pC(g)△H<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是( )
反应mA(s)+nB(g)?pC(g)△H<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是( )湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com