
题目列表(包括答案和解析)
| t/℃ | 700 | 800 | 850 | 1000 | 1200 |
| K1 | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |

| 起始浓度 | 甲 | 乙 | 丙 |
| c(CO2)(mol/L) | 0.01 | 0.02 | 0.02 |
| c(H2)(mol/L) | 0.01 | 0.01 | 0.02 |
| 1 | 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| A、Q1>Q3>Q2 |
| B、Q1>Q2>Q3 |
| C、Q2>Q1>Q3 |
| D、Q3>Q1>Q2 |
| 1 | 2 |
(1)已知下列两个热化学方程式:
C3H8(g)+5O2(g) =3CO2(g)+4H2O(l) ΔH=-2220.0 kJ·mol-1
H2O(l)=H2O(g) ΔH=+44.0 kJ·mol-1
则0.5 mol丙烷燃烧生成CO2和气态水时释放的热量为___________ 。
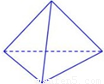
(2)科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如下图所示),与白磷分子相似。已知断裂1molN—N键吸收193kJ热量,断裂1molN N键吸收941kJ热量,则1molN4气体转化为2molN2时要放出______________
kJ能量。
N键吸收941kJ热量,则1molN4气体转化为2molN2时要放出______________
kJ能量。
(3)阿波罗宇宙飞船上使用的是氢氧燃料电池,其电池总反应为:
2H2+O2 =2H2O,电解质溶液为稀H2SO4溶液,电池放电时是将_________能转化为___________能。其电极反应式分别为:
负极_________________________,正极_____________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com