
题目列表(包括答案和解析)
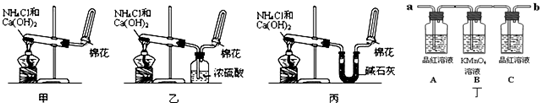
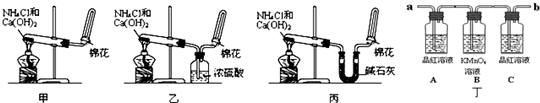
实验室用加热二氧化锰与浓盐酸的混合物制备氯气:
MnO2+4HCl(浓)一套完整的氯气实验室制备装置应该由四部分构成
(如图).同学们需要注意实验仪器的连接和作用.
A.分液漏斗:用来盛放液体试剂,本实验用来盛装浓盐酸.
B.圆底烧瓶:做反应容器,内放固体物质,本实验盛装的是固体二氧化锰.在加浓盐酸时要注意液体的量不能超过烧瓶容积的________,而且加热时要________,使烧瓶底部均匀受热,避免受热不均而炸裂.
C.除杂装置:第一个洗气瓶内盛有饱和食盐水,它的作用是除去氯气中混有的氯化氢杂质;第二个洗气瓶内盛有浓硫酸,用于除去氯气中混有的水蒸气.洗气瓶中两个导管的插入原则是“长进短出”.除杂的顺序是先除氯化氢,后除水蒸气.如果顺序颠倒,不能起到除杂的作用,原因是________.
D.集气装置:用来收集密度比空气大的气体要用向上排空气法.如果不需要收集干燥的氯气,也可以使用________的方法.
E.尾气吸收:因为氯气有毒,会污染环境,多余的氯气不能排放到大气中,选用________进行尾气处理.
选做题
本题有A、B两题,分别对应于“物质结构与性质”和“实验化学”两个选修课程模块的内容,每题12分。请选择其中一题作答,若两题都作答,则以A题得分计入总分。
20A.过渡元素在生活、生产和科技等方面有广泛的用途。
(1)应用于合成氨反应的催化剂(铁)的表面上存在氮原子,右图为氮原子在铁的晶面上的单层附着局部示意图(图中小黑色球代表氮原子,灰色球代表铁原子)。则图示铁颗粒表面上氮原子与铁原子的个数比为 。

(2)现代污水处理工艺中常利用聚合铁{简称PFS,化学式为:[Fe2(OH)n(SO4)3-n/2]m,n<5,m<10}在水体中形成絮状物,以吸附重金属离子。下列说法中不正确的是 。(填序号)
A.PFS中铁显+3价
B.铁原子的价电子排布式是3d64s2
C.由FeSO4溶液制PFS需经过氧化、水解和聚合的过程
D.由下表可知气态Fe2+再失去一个电子比气态Mn2+再失去一个电子难
| 元素 | Mn | Fe | |
| 电离能 (kJ・mol-1) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 |
(3)铬的配合物在药物应用、设计合成新磁材料领域和聚乙烯催化剂方面都有重要应用。现有铬(Ⅲ)与甲基丙烯酸根的配合物为:
①该化合物中存在的化学键类型有 。
②该化合物中一个Cr的配位数为 。
③甲基丙烯酸分子中C原子的杂化方式有 。
④等电子体是具有相同的价电子数和原子数的分子或离子,与H2O分子互为等电子体的微粒是 。(填一种即可)
⑤与铬同周期的所有元素中基态原子最外层电子数与铬原子相同的元素是
____ 。(填元素符号)
 |
在生成乙酰水杨酸的同时,水杨酸分子之间也能发生聚合反应,生成少量聚合物(副产物)。合成乙酰水杨酸的实验步骤如下:
①向150mL干燥锥形瓶中加入2 g水杨酸、5 mL乙酸酐和5滴浓硫酸,振荡,待其溶解后,控制温度在85℃~90℃条件下反应5~10 min,然后冷却,即有乙酰水杨酸晶体析出。
②减压过滤,用滤液淋洗锥形瓶,直至所有晶体收集到布氏漏斗中。抽滤时用少量冷水洗涤晶体几次,继续抽滤,尽量将溶剂抽干。然后将粗产品转移至表面皿上,在空气中风干。
③将粗产品置于100 mL烧杯中,搅拌并缓慢加入25 mL饱和碳酸氢钠溶液,加完后继续搅拌2~3 min,直到没有二氧化碳气体产生为止。过滤,用5~10 mL蒸馏水洗涤沉淀。合并滤液于烧杯中,不断搅拌,慢慢加入15 mL 4mol / L盐酸,将烧杯置于冰水中冷却,即有晶体析出。抽滤,用冷水洗涤晶体1~2次,再抽干水分,即得产品。
(1)第①步中,要控制温度在85℃~90℃,应采用的加热方法是 ,用这种方法加热需要的玻璃仪器有 。
(2)在第②步中,用冷水洗涤晶体,其目的是 、 。
(3)在第③步中,加入饱和碳酸氢钠溶液的作用是 ,加入盐酸的作用是 。
(4)如何检验产品中是否混有水杨酸? 。
选做题
本题有A、B两题,分别对应于“物质结构与性质”和“实验化学”两个选修课程模块的内容,每题12分。请选择其中一题作答,若两题都作答,则以A题得分计入总分。
20A.过渡元素在生活、生产和科技等方面有广泛的用途。
(1)应用于合成氨反应的催化剂(铁)的表面上存在氮原子,右图为氮原子在铁的晶面上的单层附着局部示意图(图中小黑色球代表氮原子,灰色球代表铁原子)。则图示铁颗粒表面上氮原子与铁原子的个数比为 。

(2)现代污水处理工艺中常利用聚合铁{简称PFS,化学式为:[Fe2(OH)n(SO4)3-n/2]m,n<5,m<10}在水体中形成絮状物,以吸附重金属离子。下列说法中不正确的是 。(填序号)
A.PFS中铁显+3价
B.铁原子的价电子排布式是3d64s2
C.由FeSO4溶液制PFS需经过氧化、水解和聚合的过程
D.由下表可知气态Fe2+再失去一个电子比气态Mn2+再失去一个电子难
|
元素 |
Mn |
Fe |
|
|
电离能 (kJ・mol-1) |
I1 |
717 |
759 |
|
I2 |
1509 |
1561 |
|
|
I3 |
3248 |
2957 |
(3)铬的配合物在药物应用、设计合成新磁材料领域和聚乙烯催化剂方面都有重要应用。现有铬(Ⅲ)与甲基丙烯酸根的配合物为:

①该化合物中存在的化学键类型有 。
②该化合物中一个Cr的配位数为 。
③甲基丙烯酸分子中C原子的杂化方式有 。
④等电子体是具有相同的价电子数和原子数的分子或离子,与H2O分子互为等电子体的微粒是 。(填一种即可)
⑤与铬同周期的所有元素中基态原子最外层电子数与铬原子相同的元素是
____ 。(填元素符号)
 |
在生成乙酰水杨酸的同时,水杨酸分子之间也能发生聚合反应,生成少量聚合物(副产物)。合成乙酰水杨酸的实验步骤如下:
①向150 mL干燥锥形瓶中加入2 g水杨酸、5 mL乙酸酐和5滴浓硫酸,振荡,待其溶解后,控制温度在85℃~90℃条件下反应5~10 min,然后冷却,即有乙酰水杨酸晶体析出。
②减压过滤,用滤液淋洗锥形瓶,直至所有晶体收集到布氏漏斗中。抽滤时用少量冷水洗涤晶体几次,继续抽滤,尽量将溶剂抽干。然后将粗产品转移至表面皿上,在空气中风干。
③将粗产品置于100 mL烧杯中,搅拌并缓慢加入25 mL饱和碳酸氢钠溶液,加完后继续搅拌2~3 min,直到没有二氧化碳气体产生为止。过滤,用5~10 mL蒸馏水洗涤沉淀。合并滤液于烧杯中,不断搅拌,慢慢加入15 mL 4mol / L盐酸,将烧杯置于冰水中冷却,即有晶体析出。抽滤,用冷水洗涤晶体1~2次,再抽干水分,即得产品。
(1)第①步中,要控制温度在85℃~90℃,应采用的加热方法是 ,用这种方法加热需要的玻璃仪器有 。
(2)在第②步中,用冷水洗涤晶体,其目的是 、 。
(3)在第③步中,加入饱和碳酸氢钠溶液的作用是 ,加入盐酸的作用是 。
(4)如何检验产品中是否混有水杨酸? 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com