
题目列表(包括答案和解析)
| A、2H2(g)+O2(g)=2H2O(l)△H=-285.8kJ?mol-1 | ||
| B、CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=+890.3kJ?mol-1 | ||
C、H2(g)+
| ||
| D、C(s)+2H2(g)=CH4(g)△H=-74.8kJ?mol-1 |
25 ℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ·mol-1、285.8 kJ·mol-1、890.3 kJ·mol-1、2 800 kJ·mol-1,则下列热化学方程式正确的是????? ( )。
A.C(s)+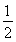 O2(g)=CO(g)??? ΔH=-393.5 kJ·mol-1
O2(g)=CO(g)??? ΔH=-393.5 kJ·mol-1
B.2H2(g)+O2(g)=2H2O(g)???? ΔH=+571.6 kJ·mol-1
C.CH4(g)+2O2(g)=CO2(g)+2H2O(g)??? ΔH=-890.3 kJ·mol-1
D.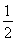 C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l)??? ΔH=-1 400 kJ·mol-1
C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l)??? ΔH=-1 400 kJ·mol-1
氢气是人类最理想的能源。已知在25℃、101kPa下,1 g氢气完全燃烧生成液态水时放出热量142.9kJ,今有如下三个热化学方程式:
(1)H2(g)+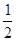 O2(g)
= H2O(g) ΔH1=a kJ·mol-1
O2(g)
= H2O(g) ΔH1=a kJ·mol-1
(2)H2O(l) = H2(g)+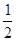 O2(g)
ΔH2=b kJ·mol-1
O2(g)
ΔH2=b kJ·mol-1
(3)2H2(g)+O2(g) = 2H2O(l) ΔH3=c kJ·mol-1
下列关于它们的表述正确的是
A.2b=c B.b=285.8
C.a=-b? D.氢气的燃烧热为a kJ·mol-1
25℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ•mol-1、285.8 kJ•mol-1、890.3 kJ•mol-1、2 800 kJ•mol-1,则下列热化学方程式正确的是( )
A. C(s)+1/2 O2(g)===CO(g) △H=-393.5 kJ•mol-1
B. 2H2(g)+O2(g) ===2H2O(g)△H=+571.6 kJ•mol-1
C. CH4(g)+2O2(g) === CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1
D. 1/2C6H12O6(s)+3O2(g) ===3CO2(g)+3H2O(l) △H=-1 400 kJ•mol-1
25℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ•mol-1、285.8 kJ•mol-1、890.3 kJ•mol-1、2 800 kJ•mol-1,则下列热化学方程式正确的是( )
A. C(s)+1/2 O2(g) ===CO(g) △H=-393.5 kJ•mol-1
B. 2H2(g)+O2(g) ===2H2O(g) △H=+571.6 kJ•mol-1
C. CH4(g)+2O2(g) === CO2(g)+2H2O(g) △H=-890.3 kJ•mol-1
D. 1/2C6H12O6(s)+3O2(g) ===3CO2(g) +3H2O(l) △H=-1 400 kJ•mol-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com