
题目列表(包括答案和解析)
| 500℃ |
| 1000℃ |
| 1000℃ |
| x | y | z |
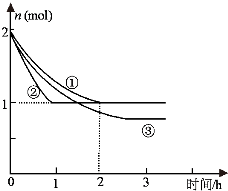 合成氨反应N2(g)+3H2(g)?2NH3(g)△H=-94.2kJ?mol-1,分别在反应条件不同,但体积均为2L的三个固定体积的容器中反应,起始时N2、H2和NH3的物质的量分别为2mol、6mol、0mol,N2的物质的量随时间的变化如图所示.
合成氨反应N2(g)+3H2(g)?2NH3(g)△H=-94.2kJ?mol-1,分别在反应条件不同,但体积均为2L的三个固定体积的容器中反应,起始时N2、H2和NH3的物质的量分别为2mol、6mol、0mol,N2的物质的量随时间的变化如图所示.
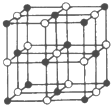 A、B、D、E是短周期中构成蛋白质的重要元素,其性质见下表.Fe、Co元素的常见化合价为+2、+3,能形成各种有色配离子.
A、B、D、E是短周期中构成蛋白质的重要元素,其性质见下表.Fe、Co元素的常见化合价为+2、+3,能形成各种有色配离子.| A | B | D | E | |
| 化合价 | -4 | -2 | -3 | -2 |
| 电负性 | 2.5 | 2.5 | 3.0 | 3.5 |
| ||
| ||
| ||
| ||
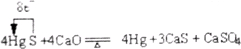
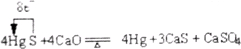
(16分)尿素(H2NCONH2)是一种非常重要的高氮化肥,工业上合成尿素的反应分为如下两步:
第1步:2NH3(l)+CO2(g) H2NCOONH4(氨基甲酸铵) (l) △H1= —330.0 kJ·mol-1
第2步:H2NCOONH4(l)H2O(l)+H2NCONH2(l) △H2=+226.3 kJ·mol-1
(1)写出工业合成尿素的热化学方程式:
(2)下列措施中有利于提高尿素的产率的是___________。
A.采用高温 B.采用高压 C.添加高效催化剂 D.定时分离尿素
(3)某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如下图所示:
①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第 步反应决定。
②反应进行到10 min时测得CO2的物质的量如上图所示,则用CO2表示的第一步反应的速率v(CO2)= 。
(4)工业上合成氨常与尿素生产联合进行以提高经济效益,合成氨的热化学方程式如下:
N2(g) + 3H2(g) 2NH3(g) △H = —92.4 kJ/mol
请在答题卡的坐标图中,画出反应过程中体系的能量变化图(进行必要的标注)。
(5)有一工业投产前小实验:在一定温度和压强下,将6 molH2和2 molN2在2L密闭容器中混合,当该反应达到平衡时,测得平衡混合气中NH3的体积分数约为11.1%(即1/9),此时H2的转化率是多少?(写出计算过程,计算结果保留3位有效数字。)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com