
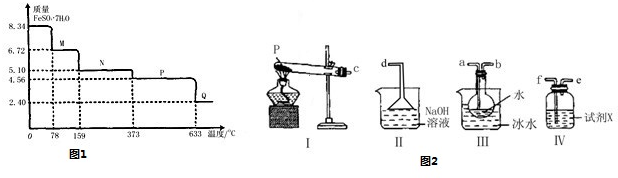
题目列表(包括答案和解析)
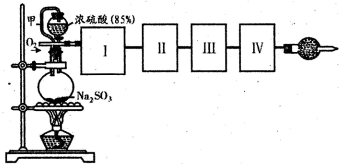
实验室用图5-18装置制取溴化亚铁.其中A为![]() 发生装置,D和d中均盛有液溴,E为外套电热丝的不锈钢管,e是两只耐高温的瓷皿,其中共盛有56g细铁粉.实验开始时先将铁粉加热至600~700℃,然后将干燥纯净的
发生装置,D和d中均盛有液溴,E为外套电热丝的不锈钢管,e是两只耐高温的瓷皿,其中共盛有56g细铁粉.实验开始时先将铁粉加热至600~700℃,然后将干燥纯净的![]() 气流通入D中,E管中反应开始,最后将d中液溴满入100~120℃的D中,经过几小时的连续反应,在钢管的一端沉积有黄绿色鳞片状溴化亚铁80g
气流通入D中,E管中反应开始,最后将d中液溴满入100~120℃的D中,经过几小时的连续反应,在钢管的一端沉积有黄绿色鳞片状溴化亚铁80g

请回答:
(1)如何检查用塞子塞紧的D(插有导管和仪器)的气密性?答________.
(2)若导入的不干燥,会在E中发生副反应,其化学方程式为:________.若在A中盛固体![]() ,a中盛6mol/L盐酸,为使导入D中的
,a中盛6mol/L盐酸,为使导入D中的![]() 为干燥纯净的气体,则图中B、C处的装置和其中的试剂应是:B为________,C为________.
为干燥纯净的气体,则图中B、C处的装置和其中的试剂应是:B为________,C为________.
(3)实验时,装置D和E的橡皮塞最好用铝箔包住,原因是________.
(4)反应过程中要不断通入![]() ,其主要作用是:①________,②________.
,其主要作用是:①________,②________.
(5)E中的反应为:![]() ,
,![]()
![]()
![]() .则此实
.则此实
验中溴化亚铁的产率为________.
(6)为防止污染空气,实验时应在F处连接盛________的尾气吸收装置.
| 64n-m |
| 64n |
| 64n-m |
| 64n |
| ||
| ||
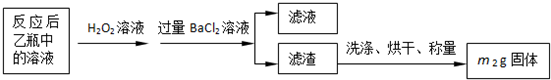
| 32m2 |
| 233m1 |
| 32m2 |
| 233m1 |
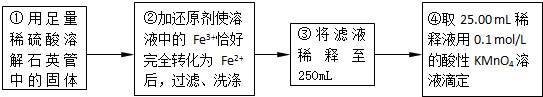
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗KMnO4溶液体积/mL | 25.00 | 25.03 | 24.97 |
A.(物质结构与性质)A、B、C、D分别代表四种不同的元素。A原子的最外层电子排布为ns1,B原子的价电子排布为ns2np2,C原子的最外层电子数是其电子层数的3 倍,D原子的L电子层的p轨道有3个电子。
(1)C原子的电子排布式为_____________,若A原子的最外层电子排布为1s1,则按原子轨道的重迭方式判断,A与C形成的化合物中的共价键类型属于_____________,A与C所形成的化合物的熔、沸点明显高于A与C的同主族元素所形成的化合物的熔、沸点,其原因是_____________________________________________________________________。
(2)当n=2时,B原子的结构示意图为_________,B与C形成的晶体属于________晶体。
当n=3时,B与C形成的晶体中,B原子的杂化方式为________________________,该晶体中最小的环共有________个微粒构成,微粒间的作用力是____________________________。
(3)若A原子的最外层电子排布为4s1,B原子的价电排布为3s23p2,A在元素周期表中的位置是_____________,A、B、C、D四种元素的第一电离能由大到小的顺序是____________(用元素符号表示)。
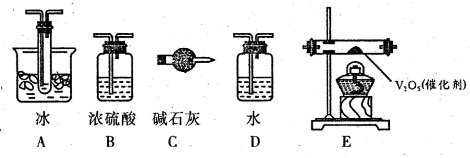
B.(实验化学 )某化学研究性学习小组进行了一系列“带火星的木炭复燃”的实验,实验装置如下图所示。

(1)甲组同学探究“使带火星木炭复燃时O2的体积分数的极限”。将氧气和空气(假定空气中O2的体积分数为20%)按不同的体积比混合得100 mL气体A进行实验,实验记录如下:
编号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ | Ⅴ |
V(O2)/mL | 60 | 40 | 20 | 12 | 10 |
V(空气)/mL | 40 | 60 | 80 | 88 | 90 |
B中的现象 | 木炭复燃 | 木炭复燃 | 木炭复燃 | 木炭有时燃烧,有时不燃烧 | 木炭不复燃 |
回答下列问题:
①使带火星木炭复燃的O2的体积分数最小约为_____________。
②用带火星木炭检验集气瓶里是否集满O2,若木炭复燃,能否认为集气瓶里的气体一定是纯净的O2?_____________(填“能”或“否”)。
③若按照3∶2的比例混合O2和CO2气体,该混合气体能否使带火星的木炭复燃?_____________(填“能”“否”或“不一定”)。
(2)乙组同学探究“NO2能否支持燃烧”的问题,设计了如下几组实验,实验记录及结论如下:
编号 | 制取气体A(下列反应产生的混合气体) | B中的现象 | 结论 |
a | 在烧瓶中加热适量浓硝酸 4HNO3 | 充满红棕色气体,木炭不复燃,火星熄灭 | NO2不支持燃烧 |
b | 加热AgNO3固体 2AgNO3 | 充满红棕色气体,木炭复燃 | NO2支持燃烧 |
c | 加热Cu(NO3)2固体 2Cu(NO3)2 | 充满红棕色气体,木炭复燃 | NO2支持燃烧 |
你认为a、b、c三个结论是否可靠?说出你的理由。
a.__________,原因是__________________________________________________。
b.__________,原因是__________________________________________________。
c.__________,原因是__________________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com