
题目列表(包括答案和解析)
(1)钠与水反应的现象:___________________。钾与水反应的现象:____________________。
(2)两个实验现象的相同点有哪些?产生这些现象的本质原因应该归于原子结构的哪些特征?_________________________________________________________________。
(3)两个实验现象的不同点有哪些?产生这些现象的本质原因应该归于原子结构的哪些特征?___________________________________________________________________。
(4)根据钠和钾的原子结构以及化学性质的对比,可推导出碱金属元素失电子能力的强弱顺序该是怎样的?_________________________________________________________________。
| |||||||||||||||||||||||||||
钠的性质实验:
(1)钠的氧化:用________从试剂瓶中取出一小块钠,先将钠表面的煤油用滤纸吸干,然后再用小刀切割.可以观察到新切开的断面呈现________,很快此断面逐渐变暗,原因是________.(2)钠的燃烧:取一小块擦去煤油的金属钠,放在坩埚上加热,可以观察到钠的表面逐渐熔化,发出________火焰;燃烧后的固体产物呈________色,其成分是________.
(3)钠与水的反应:取切绿豆大小的钠粒,同时要将多余的钠块________.将切下的钠块投入盛有水的烧杯中(事先滴入几滴酚酞溶液),看到的现象可以概括为:“浮”、“熔”、“游”、“嘶”、“红”.对现象的相应解释是:钠的密度比水的小、钠与水反应放热且放出的热使具有较低熔点的钠熔化、生成的氢气推动钠在水面上四处游动、发生嘶嘶声至完全消失、钠与水反应生成了碱性物质——NaOH.
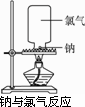
(1)实验步骤:取一块绿豆大的金属钠(切去氧化层),用滤纸吸净煤油,放在石棉网上,用酒精灯微热。待钠熔成球状时,将盛有氯气的集气瓶迅速倒扣在钠的上方,观察现象。
(2)记录实验现象
现象 |
|
化学方程式 |
|

钠与氯气反应
下面是钠和氯气反应的实验设计:
(1)实验步骤:取一块绿豆大的金属钠(切去氧化层),用滤纸吸净煤油,放在石棉网上,用酒精灯微热.待钠熔成球状时,将盛有氯气的集气瓶迅速倒扣在钠的上方,观察现象.
(2)记录实验现象
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com