
题目列表(包括答案和解析)
原子序数依次增大的四种元素A、B、C、D分别处于第一至第四周期,自然界中存在多种A的化合物,B原子核外电子有6种不同的运动状态,B与C可形成正四面体形分子,D的基态原子的最外能层只有一个电子,其他能层均已充满电子。
请回答下列问题:
(1)这四种元素中电负性最大的元素,其基态原子的价电子排布图为________,第一电离能最小的元素是________(填元素符号)。
(2)C所在主族的前四种元素分别与A形成的化合物,沸点由高到低的顺序是________(填化学式),呈现如此递变规律的原因是___________________。
(3)B元素可形成多种单质,一种晶体结构如图一所示,其原子的杂化类型为________。另一种的晶胞如图二所示,若此晶胞中的棱长为356.6 pm,则此晶胞的密度为________________________________________________g·cm-3(保留两位有效数字)。( =1.732)
=1.732)

图一 图二 图三
(4)D元素形成的单质,其晶体的堆积模型为________,D的醋酸盐晶体局部结构如图三,该晶体中含有的化学键是________(填选项序号)。
①极性键 ②非极性键 ③配位键 ④金属键
(5)向D的硫酸盐溶液中滴加过量氨水,观察到的现象是________。请写出上述过程的离子方程式:_________________________________________。
 =1.732)
=1.732)
(1)X原子在第二电子层上只有一个空轨道,则X是 ;其轨道表示式为 ;R原子的3p轨道上只有一个未成对电子,则R原子可能是 、 ;Y原子的核电荷数为29,其电子排布式是 ,其在元素周期表中的位置是 ,是属于 区的元素。
(2)指出配合物K3[Co(CN)6]中的中心离子、配位体及其配位数:_________、__________、________。
(3)下列分子中若有手性原子,请用“*”标出其手性碳原子。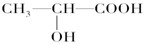
(4)在下列物质①CO2、②NH3、③CCl4、④BF3、⑤H2O、⑥SO2、⑦SO3、⑧PCl3中,属于非极性分子的是(填序号)________________。
(5) 试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”):H2SO4________H2SO3; H3PO4________H3PO3。
(6)根据价层电子对互斥理论判断下列问题:
H2O中心原子的杂化方式为 杂化,分子的立体构型为 。
BF3分子中,中心原子的杂化方式为 杂化,分子的立体构型为 。
(7)H2O的沸点(100℃)比H2S的沸点(-61℃)高,这是由于___________________________。
A、B、C、D、E为原子序数依次增大的五种短周期元素,其中仅含有一种金属元素,A和D最外层电子数相同;B、C和E在周期表中相邻,且C、E同主族。B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成两种常见的液态化合物。
请回答下列问题:;
(1)B的原子结构示意图 ;
(2)C、D、E三种原子对应的离子半径由大到小的顺序是 (填具体离子);由A、B、C三种元素按4:2:3组成的化合物所含的化学键类型属于 。
(3)用某种废弃的金属易拉罐与A、C、D组成的化合物溶液反应,该反应的离子方程式为: 。
(4)在100mL18mol/L的浓的A、C、E 组成酸溶液中加入过量的铜片,加热使之充分反应,产生的气体在标准状况下的体积可能是 ;(填序号)
a.7.32L b.6.72L c.20.16L d.30.24L
若使上述反应中剩余的铜片继续溶解,可向其中加入硝酸钠,反应的离子方程式为:
。
(5)A、C两元素的单质与熔融K2CO3组成的燃料电池,其负极反应式
用该电池电解1L1mol/LNaCl溶液,当消耗标准状况下1.12LH2时,NaCl溶液的PH= (假设电解过程中溶液的体积不变)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com