
题目列表(包括答案和解析)
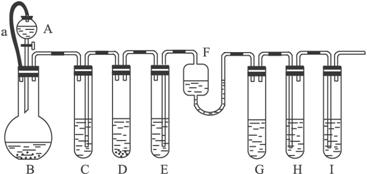
各装置中试剂或物质为:
A:2 mol·L-1 H2SO4 B:Zn C:2 mol·L-1 H2SO4和CuSO4混合液 D:Zn E:CuSO4 F:NH3·H2OG:30% H2O2 H:饱和的H2S溶液 I:NaOH溶液
已知:Cu2++4NH3·H2O====[Cu(NH3)4]2++4H2O,其产物可作H2O2分解的催化剂。
请完成下列问题:
(1)“化学多米诺实验”成功的关键之一是控制好第一个反应,关键之二是____________。
(2)B与D两容器中反应速率比较B______D(填“>”“<”或“=”=,原因是______
_________________________________________________。
(3)H中的现象是________________________________________。
(4)I的作用是(用离子方程式表示)____________________。
(5)A和B之间的导管a的作用是_____________________________。
(6)在该实验中不涉及的反应类型是(填序号)。
A.分解反应 B.化合反应 C.置换反应 D.复分解反应
(7)如果从H中导出的气体是极易溶于水的气体,下列哪个装置能代替I?填序号______。
 氧气是化工生产的重要原料,很多金属和非金属都能和氧气直接作用.
氧气是化工生产的重要原料,很多金属和非金属都能和氧气直接作用.| 氧化物 | MgO | CaO | SrO | BaO |
| 晶格能/kJ?mol-1 | 3791 | 3410 | 3223 | 3054 |
应用生物工程技术获得人们需要的生物新品种或新产品,是生物科学技术转化为生产力的重要体现。请据图回答下列问题:

(1)在培育转基因牛的过程中,①过程需要的工具酶是 ,②过程常用的方法是 。
(2)转基因牛可通过分泌乳汁来生产人生长激素,在基因表达载体中,人生长激素基因的首端必须含有 ,它是 识别和结合的部位。
(3)动物细胞培养过程中,培养环境中除须提供O2外还须混入一定量的CO2, CO2的主要作用是 。为保证被培养的动物细胞处于无菌、无毒的环境,还要在细胞培养液中添加一定量的 ,以防培养过程中的污染。
(4)prG基因的产物能激发细胞不断分裂,通过基因工程导入该调控基因来制备单克隆抗体,单克隆抗体与血清抗体相比较,其最主要的优点在于是 。
(5)⑤过程的关键步骤为 和 。
(6)棉花具有抗虫能力,说明抗虫基因在棉花细胞中得以_____ 。不同生物间基因能够移植成功并合成相同的物质,说明所有生物共用一套______________,从进化的角度看,这些生物具有____________________________。
(7)棉花细胞中的DNA分子被“嫁接”上或“切割”掉某个基因,多数情况下并不影响其它基因的表达功能。这说明_____________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com