
题目列表(包括答案和解析)
(8分)中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。
(1)有效“减碳”的手段之一是节能,下列制氢方法最节能的是
A.电解水制氢:2H2O 2H2↑+O2↑
2H2↑+O2↑
B.高温使水分解制氢:2H2O 2H2↑+O2↑
2H2↑+O2↑
C.太阳光催化分解水制氢:2H2O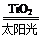 2H2↑+O2↑
2H2↑+O2↑
D.天然气制氢:CH4+H2O CO+3H2
CO+3H2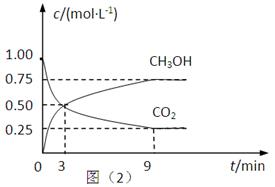
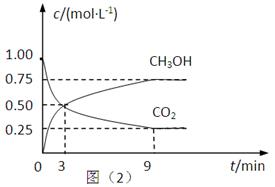
(2)CO2可转化成有机物实现碳循环。在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1,测得CO2和CH3OH(g)的浓度随时间变化如上图所示。
CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1,测得CO2和CH3OH(g)的浓度随时间变化如上图所示。
①从3 min到9 min,v(H2)=________mol·L-1·min-1。
②能说明上述反应达到平衡状态的是____________(填编号)。
A.反应中CO2与CH3OH的物质的量浓度之比为1∶1(即图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内消耗3mol H2,同时生成1mol H2O
D.CO2的体积分数在混合气体中保持不变
(3)工业上,CH3OH也可由CO和H2合成。参考合成反应CO(g)+2H2(g) CH3OH(g)的平衡常数:
CH3OH(g)的平衡常数:
| 温度/℃ | 0 | 100 | 200 | 300 | 400 |
| 平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
(8分)中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。
(1)有效“减碳”的手段之一是节能,下列制氢方法最节能的是
A.电解水制氢:2H2O 2H2↑+O2↑
2H2↑+O2↑
B.高温使水分解制氢:2H2O 2H2↑+O2↑
2H2↑+O2↑
C.太阳光催化分解水制氢:2H2O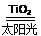 2H2↑+O2↑
2H2↑+O2↑
D.天然气制氢:CH4+H2O CO+3H2
CO+3H2
(2)CO2可转化成有机物实现碳循环。在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1,测得CO2和CH3OH(g)的浓度随时间变化如上图所示。
CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1,测得CO2和CH3OH(g)的浓度随时间变化如上图所示。
①从3 min到9 min,v(H2)=________mol·L-1·min-1。
②能说明上述反应达到平衡状态的是____________(填编号)。
A.反应中CO2与CH3OH的物质的量浓度之比为1∶1(即图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内消耗3mol H2,同时生成1mol H2O
D.CO2的体积分数在混合气体中保持不变
(3)工业上,CH3OH也可由CO和H2合成。参考合成反应CO(g)+2H2(g) CH3OH(g)的平衡常数:
CH3OH(g)的平衡常数:
|
温度/℃ |
0 |
100 |
200 |
300 |
400 |
|
平衡常数 |
667 |
13 |
1.9×10-2 |
2.4×10-4 |
1×10-5 |
下列说法正确的是_____。
A.该反应正反应是放热反应
B.该反应在低温下不能自发进行,高温下可自发进行,说明该反应△S<0
C.在T℃时,1L密闭容器中,投入0.1mol CO和0.2 mol H2,达到平衡时,CO转化率为50%,则此时的平衡常数为100
D.工业上采用稍高的压强(5Mpa)和250℃,是因为此条件下,原料气转化率最高
| A.化学反应速率是衡量化学反应进行快慢程度的物理量 |
| B.化学反应速率通常用单位时间内生成或消耗某物质的质量的多少来表示 |
| C.在同一个反应中,各物质的反应速率之比等于化学方程式中的计量数之比 |
| D.化学反应速率的常用单位有mol/(L·s)和mol/(L·min) |
下列关于化学反应速率的说法中,不正确的是( )。
| A.化学反应速率是衡量化学反应进行快慢程度的物理量 |
| B.化学反应速率通常用单位时间内生成或消耗某物质的质量的多少来表示 |
| C.在同一个反应中,各物质的反应速率之比等于化学方程式中的计量数之比 |
| D.化学反应速率的常用单位有mol/(L·s)和mol/(L·min) |
碳、氮和铝的单质及其化合物在工农业生产和生活中有重要的作用。
(1)真空碳热还原—氯化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
2Al2O3(s)+2AlCl3(g)+6C(s)=6AlCl(g)+6CO(g) △H=a kJ·mol-1
3AlCl(g) =2Al(l)+AlCl3(g) △H=b kJ·mol-1
反应Al2O3(s)+3C(s)=2Al(l)+3CO(g)的△H= kJ·mol-1(用含a、b的代数式表示);
(2)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g) N2(g)+CO2(g) △H=Q kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g) △H=Q kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
|
时间(min) 浓度(mol/L) |
0 |
10 |
20 |
30 |
40 |
50 |
|
NO |
1.00 |
0.68 |
0.50 |
0.50 |
0.60 |
0.60 |
|
N2 |
0 |
0.16 |
0.25 |
0.25 |
0.30 |
0.30 |
|
CO2 |
0 |
0.16 |
0.25 |
0.25 |
0.30 |
0.30 |
①0~10min内,NO的平均反应速率v(NO)= ,T1℃时,该反应的平衡常数K= ;
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是 (填字母编号)。
a.通入一定量的NO b.加入一定量的活性炭
c.加入合适的催化剂 d.适当缩小容器的体积
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为3:1:1,则Q 0(填“>”或“<”)。
④在恒容条件下,能判断该反应一定达到化学平衡状态的依据是 (填选项编号)。
a.单位时间内生成2n mol NO(g)的同时消耗n mol CO2(g)
b.反应体系的温度不再发生改变
c.混合气体的密度不再发生改变
d.反应体系的压强不再发生改变
(3)铝电池性能优越,Al—Ag2O电池可用作水下动力电源,其原理如下图所示:

请写出该电池正极反应式 ;常温下,用该化学电源和惰性电极电解300ml硫酸铜溶液(过量),消耗27mg Al,则电解后溶液的pH= (不考虑溶液体积的变化)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com