
题目列表(包括答案和解析)
50 mL 1.0 mol·L-1盐酸跟50 mL 1.1 mol·L-1氢氧化钠溶液在下图装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热。试回答下列问题:
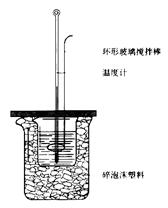
⑴大小烧杯间填满碎泡沫塑料的作
用 。
⑵ (填“能”或“不能”)将环形玻璃搅拌棒改为环形铜棒。其原因是 。
⑶大烧杯上如不盖硬纸板,对求得中和热数值的影响是
(填“偏高”或“偏低”或“无影响”)。
⑷如果改用60 mL 1.0 mol·L-1盐酸跟50 mL 1.1 mol·L-1氢氧化钠溶液进行反应,则与上述实验相比,所放热量 (“增加”、 “减少”或“不变”), 所求中和热数值 (“增加”、 “减少”或“不变”)
(5)某研究小组将装置完善后,把V1 mL 1.0 mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示
(实验中始终保持V1+V2=50 mL)。回答下列问题:
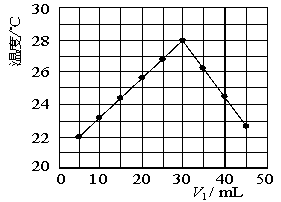
研究小组做该实验时环境温度 (填“高于”、“低于”或“等于”)22 ℃。
|
在下列各说法中,正确的是 | |
| [ ] | |
A. |
ΔH>0 kJ·mol-1表示放热反应,ΔH<0 kJ·mol-1表示吸热反应 |
B. |
热化学方程式中的化学计量数只表示物质的量,可以是分数 |
C. |
1 mol H2SO4与1 mol Ba(OH)2反应生成BaSO4沉淀时放出的热叫做中和热 |
D. |
1 mol H2与0.5 mol O2反应放出的热就是H2的燃烧热 |
|
下列说法中,正确的是 | |
| [ ] | |
A. |
热化学方程式中的化学计量数表示物质的量,可以是分数 |
B. |
ΔH>0 kJ·mol-1表示放热反应,ΔH<0 kJ·mol-1表示吸热反应 |
C. |
1 mol H2SO4与1 mol Ba(OH)2反应生成H2O时放出的热叫做中和热 |
D. |
1 mol H2与0.5 mol O2反应放出的热就是H2的燃烧热 |
|
下列关于中和热的说法中正确的是 | |
A. |
1 L 1 mol·L-1 Ba(OH)2的溶液与1 L 1 mol·L-1 HNO3溶液的反应放出的热量是中和热 |
B. |
1 mol HCl气体通入1 L 1 mol·L-1 NaOH溶液中放出的热量是中和热 |
C. |
1 mol CH3COOH与2 mol NaOH反应放出的热量也可能是中和热 |
D. |
只有强酸与强碱反应生成1 mol水放出的热量才是中和热 |
含有11.2g KOH的稀溶液与1L 0.01mol×L-1的H2SO4溶液反应,放出11.46KJ的热量,该反应的中和热化学方程式为( )
A.KOH(aq)+![]() (aq)══
(aq)══![]() (1);△H=-11.46kJ/mol
(1);△H=-11.46kJ/mol
B.2KOH(aq)+H2SO4(aq)══K2SO4(aq)+2H2O(1);△H=-114.6kJ/mol
C.2KOH(aq)+H2SO4(aq)══K2SO4(aq)+2H2O(1);△H=-114.6kJ/mol
D.KOH(aq)+![]() (aq)══
(aq)══![]() (1);△H=-57.3kJ/mol
(1);△H=-57.3kJ/mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com