
题目列表(包括答案和解析)
A. NH2D·H2O和 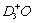 B. NH3·D2O和
B. NH3·D2O和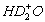
C.NH3·HDO和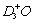 D.NH2D·H2O和H2D+O
D.NH2D·H2O和H2D+O
向少量Mg(OH)2悬浊液中加入适量的饱和NH4Cl溶液,结果固体完全溶解。对此甲、乙两同学各自作了自己的解释:
甲:Mg(OH)2(s) ![]() Mg2++2OH- ① NH4++H2O
Mg2++2OH- ① NH4++H2O![]() NH3?H2O+H+ ②
NH3?H2O+H+ ②
H++OH-=H2O ③由于③反应的发生,使平衡①右移,Mg(OH)2溶解。
乙:Mg(OH)2(s) ![]() Mg2++2OH- ① NH4++ OH-
Mg2++2OH- ① NH4++ OH-![]() NH3?H2O ②
NH3?H2O ②
由于②反应的发生,使平衡①右移,沉淀溶解。
(1)丙同学不能肯定哪位同学的解释合理,于是用下面的一种试剂重做了该实验,证明甲、乙的解释只有一种正确。他用的试剂是 。
A.NH4NO3 B.CH3COONH4 C.(NH4)2SO4 D.氨水
(2)丙同学将所选试剂滴入Mg(OH)2的浊液中,Mg(OH)2溶解;由此推知,甲和乙哪位同学的解释更合理___________(填“甲”或“乙”);完成NH4Cl饱和溶液使Mg(OH)2悬浊溶解的离子方程式_________________。
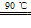 NH4ClO4(aq)+NaCl(aq)
NH4ClO4(aq)+NaCl(aq) 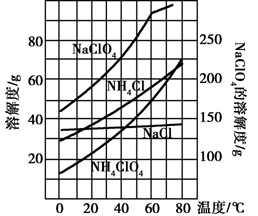
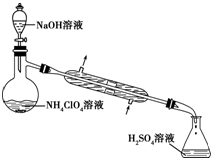
高氯酸按(NH4ClO4)是复合火箭推进剂的重要成分,实验室可通过下列反应制取NaClO4(aq)+NH4Cl(aq) NH4ClO4(aq)+NaCl(aq)
NH4ClO4(aq)+NaCl(aq)
(1)若NH4Cl用氨气和浓盐酸代替,上述反应不需要外界供热就能进行,其原因是________.
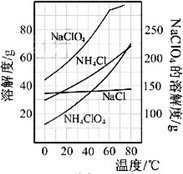
(2)反应得到的混合溶液中NH4ClO4和NaCI的质量分数分别为0.30和0.l5(相关物质的溶解度曲线见下图).从混合溶液中获得较多NH4CIO4晶体的实验操作依次为________(填操作名称)干燥.
(3)样品中NH4CIO4的含量可用蒸馏法进行测定,蒸馏装置如图所示(加热和仪器固定装代已略去),实验步骤如下:
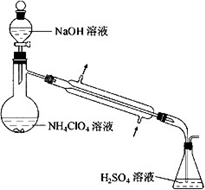
步骤1:按上图所示组装仪器,检查装置气密性.
步骤2:准确称取样品a g(约0.5 g)于蒸馏烧瓶中,加入约150 mL水溶解.
步骤3:准确量取40.00 mL约0.1 mol·L-1 H2SO4溶解于锥形瓶中.
步骤4:经滴液漏斗向蒸馏瓶中加入20 mL 3 mol·L-1 NaOH溶液.
步骤5:加热蒸馏至蒸馏烧瓶中神域约100 mL溶液.
步骤6:用新煮沸过的水冲洗冷凝装置2~3次,洗涤液并入锥形瓶中.
步骤7:向锥形瓶中加入酸碱指示剂,用c mol·L-1 NaOH标准溶液滴定至终点,消耗NaOH标准溶液V1 mL
步骤8.将实验步骤1-7重复2次
①步骤3中,准确量取40.00 ml H2SO4溶液的玻璃仪器是________.
②步骤1-7中确保生成的氨被稀硫酸完全吸收的实验是________(填写步骤号).
③为获得样品中NH4ClO4 的含量,还需补充的实验是________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com