
题目列表(包括答案和解析)
A、B为短周期元素,二者可以组合成多种中学生所熟知的化合物。在这些化合物中,A与B的原子个数比为A∶B=1∶2。已知A的原子序数为n,B的原子序数是①n+2 ②n+3 ③n+4 ④n+5 ⑤n+8
⑥n-6 ⑦n-7 ⑧n-8中的几种,其中不符合题目要求的是( )
A.①④ B.②⑧
C.③⑤ D.⑥⑦
|
A、B为短周期元素,二者可以组合成多种中学生所熟知的化合物.在这些化合物中,A与B的原子个数比为A∶B=1∶2.已知A的原子序数为n,B的原子序数是①n+2;②n+3;③n+4;④n+5;⑤n+8;⑥n-5;⑦n-7;⑧n-8中的几种,其中不符合题目要求的是 | |
| [ ] | |
A. |
①④ |
B. |
②⑧ |
C. |
③⑤ |
D. |
⑥⑦ |
利用化学原理可以对工厂排放的废水进行有效检测与合理处理.
(1)染料工业排放的废水中含有大量有毒的NO2-,可以在碱性条件下加入铝粉除去(加热处理后的废水,会产生能使湿润的红色石蕊试纸变蓝的气体).除去NO2-的离子方程式为
________.(2)废水中的N、P元素是造成水体富营养化的关键因素,农药厂排放的废水中常含有较多的NH4+和PO43-,一般可以通过两种方法将其除去.
①方法一:将Ca(OH)2或CaO投加到待处理的废水中,生成磷酸钙,从而进行回收.当处理后的废水中c(Ca2+)=2×10-7 mol/L时,溶液中c(PO43-)=
________mol/L.(已知Ksp[Ca3(PO4)2]=2×10-33)②方法二:在废水中加入镁矿工业废水,就可以生成高品位的磷矿石―鸟粪石,反应的方程式为Mg2++NH4++PO43-=MgNH4PO4↓.该方法中需要控制污水的pH为7.5~10,若pH高于10.7,鸟粪石的产量会大大降低.其原因可能为
_____________.与方法一相比,方法二的优点为_______________.(3)三氯乙烯在印刷、纺织等行业应用广泛,为了减少其对环境的影响,可将三氯乙烯在二氧化钛薄膜上催化降解,其反应的机理如下:
●CCl2=CHCl+Cl→CCl2CHCl2
●CCl2CHCl2+O2→OOCCl2CHCl2
●
OOCCl2CHCl2→OCCl2CHCl2+1/2O2●OCCl2CHCl2→CHCl2COCl+Cl
该反应的总化学反应为
_____________.中学化学中几种常见物质的转化关系如图所示(图中部分反应物或生成物及反应条件未列出).
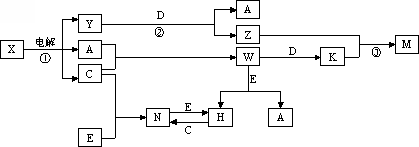
已知:常温下,A、C为气态单质,B、D、E是固态单质,组成它们的元素的原子序数依次为a、c、b、d、e;且3(a+b)=2(a+c)=3(d-a),X、Y、Z、M、N、W、H、K是化合物,其中X是B和C的化合产物的水溶液.请回答下列问题:
(1)用电子式表示X中溶质的形成过程:________,组成D的元素的原子结构示意图是________.
(2)写出B在氧气中燃烧生成的产物与H2O反应的化学方程式:________.
(3)组成单质B、C、D的三种元素简单离子的离子半径由大到小的顺序是________>________>________(用离子符号表示).
(4)常温下,N溶液的PH<7,原因是________(写出相应离子方程式);
写出M在水溶液中电离的方程式________.
硝酸盐受热分解的产物与硝酸盐的组成以及受热的温度等因素有关。
Ⅰ.一定条件下硝酸铵受热分解的化学反应方程式为:NH4NO3→HNO3+N2 +H2O(未配平)
(1)该反应中发生还原反应的过程是_______→________。
(2)反应中被氧化与被还原的氮原子数之比为__________;现有1mol NH4NO3分解,生成的氧化产物的物质的量是 mol。
Ⅱ.硝酸铵受撞击或高温发生爆炸的化学反应方程式为:m NH4NO3→n O2+p N2+q H2O
(3)下列关于该方程式中化学计量数的说法正确的是_________(选填字母编号)。
a.m=1 b.n=2 c.p=3 d.q=4
(4)若反应过程中共转移3.01×1023个电子,则反应可产生气体的体积为_____(标准状况)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com