
题目列表(包括答案和解析)
(10分)饮用水安全状况与人类健康有着密切关系。重金属离子对河流、海洋会造成严重污染。沉淀法是处理含重金属离子污水常用的方法。
某工厂废水(pH=2.0,ρ=1.0 g·mL-1)中含Ag+、Pb2+等重金属离子,其浓度各约为0.01mol·L-1。排放前拟用沉淀法除去这两种离子,查找有关数据如下:
| 难溶电解质 | AgCl | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
| Ksp | 1.8×10-10 | 8.3×10-17 | 5.6×10-18 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |

| A.NaOH | B.Na2S | C.KI | D.Ca(OH)2 |
 (2)如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)= 。
(2)如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)= 。 (3)如果用食盐处理其只含银离子的废水,测得处理后的废水中NaCl的质量分数为0.117%,若环境要求排放标准为c(Ag+)低于1.0×10-18mol·L-1,则该工厂处理后的废水是否符合排放标准 。
(3)如果用食盐处理其只含银离子的废水,测得处理后的废水中NaCl的质量分数为0.117%,若环境要求排放标准为c(Ag+)低于1.0×10-18mol·L-1,则该工厂处理后的废水是否符合排放标准 。 (填“是”或 “否”)写出计算过程。
(填“是”或 “否”)写出计算过程。Ⅰ.电离平衡常数(用K表示)的大小可以判断电解质的相对强弱。25℃时,有关物质的电离平衡常数如下表所示:
|
化学式 |
HF |
H2CO3 |
HClO |
|
电离平衡常数 (K) |
7.2×10-4 |
K1=4.4×10-7 K2=4.7×10-11 |
3.0×10-8 |
(1)物质的量浓度均为0.1mol/L的下列四种溶液:①Na2CO3溶液 ②NaHCO3溶液 ③NaF溶液 ④NaClO溶液。依据数据判断pH由大到小的顺序是______________。
(2)25℃时,在20mL0.1mol·L—1氢氟酸中加入VmL0.1mol·L—1NaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是_______。

A.pH=3的HF溶液和pH=11的NaF溶液中,由水电离出的c(H+)相等
B.①点时pH=6,此时溶液中,c(F-)-c(Na+)=9.9×10-7mol/L
C.②点时,溶液中的c(F-)=c(Na+)
D.③点时V=20mL,此时溶液中c(F-)<c(Na+)=0.1mol·L—1
(3)已知25℃时,①HF(aq)+OH-(aq)=F-(aq)+H2O(l) ΔH=-akJ·mol—1,
②H+(aq)+OH-(aq)=H2O(l) ΔH=-bkJ·mol—1,
氢氟酸的电离方程式及热效应可表示为________________________。
(4)长期以来,一直认为氟的含氧酸不存在。1971年美国科学家用氟气通过细冰末时获得HFO,其结构式为H—O—F。HFO与等物质的量的H2O反应得到HF和化合物A,则每生成1molHF转移_______mol电子。
Ⅱ.氯化硫酰(SO2Cl2)主要用作氯化剂。它是一种无色液体,熔点–54.1℃,沸点69.1℃。氯化硫酰可用干燥的二氧化硫和氯气在活性炭催化剂存在下反应制取:
SO2(g)+Cl2(g) SO2Cl2(l) △H=–97.3kJ·mol—1
SO2Cl2(l) △H=–97.3kJ·mol—1
(1)试写出常温常压下化学平衡常数K的表达式:K=_________________;
(2)对上述反应,若要使化学平衡常数K增大,化学反应速率v正也增大,可采取的措施是_____(选填编号)。
a.降低温度 b.移走SO2Cl2
c.增加反应物浓度 d.无法满足上述条件
(3)下列描述中能说明上述反应已达平衡的是____________(选填编号)。
a.υ(Cl 2)=υ(SO2) b.容器中气体压强不随时间而变化
c.c(Cl 2) : c(SO2)=1:1 d.容器中气体颜色不随时间两变化
(4)300℃时,体积为1L的密闭容器中充入16.20g SO2Cl2,达到平衡时容器中含SO2 7.616g。若在上述中的平衡体系中,再加入16.20g SO2Cl2,当再次达平衡时,容器中含SO2的质量范围是________________________。
(13分)由方铅矿(PbS)制备Pb和PbO2的方法如下:

PbO与焦炭煅烧时可能会发生如下反应:
PbO(s)+C(s)=Pb(s)+CO(g) ΔH=+108.5 kJ·mol—1 ①
PbO(s)+CO(g)=Pb(s)+CO2(g) ΔH=-64 kJ·mol—1 ②
(1)已知Pb与O2反应的热化学方程式为:2Pb(s)+O2(g)=2PbO(s) ΔH=-438 kJ·mol—1
则C完全燃烧的热化学方程式为 。
(2)能提高反应②中PbO转化率的措施有 (填字母)。
a.升高温度 b.增大压强 c.加入焦炭 d.加入催化剂
(3)制备过程中会产生SO2、NO、CO等有毒气体,可将它们按一定比例混合在一定条件下反应得到S、N2和CO2。若SO2与NO的体积比为1∶2,该反应的化学方程式为 。
(4)水溶液中铅的存在形态有多种,各形态的浓度分数α随溶液pH变化的关系如下图所示:
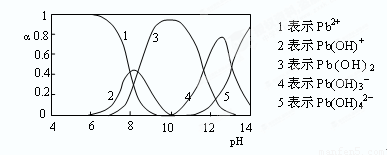
pH=6.5时,Pb2+水解的离子方程式为 ;加入NaClO制备PbO2之前需先用NaOH调节溶液pH至12.5,理由是 。
铁元素是重要的金属元素,单质铁在工业和生活中使用得最为广泛。铁还有很多重要的化合物及其化学反应。如铁与水反应:3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g) △H
(1)上述反应的平衡常数表达式K=_______。
(2) 已知:①3Fe(s)+2O2(g)=Fe3O4(s) △H1=-1118.4kJ/mol
②2H2(g)+O2(g)=2H2O(g) △H2=-483.8kJ/mol
③2H2(g)+O2(g)=2H2O(l) △H3=-571.8kJ/mol
则△H=_______。
(3)在t0C时,该反应的平衡常数K=16,在2L恒温恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
|
|
Fe |
H2O(g) |
Fe3O4 |
H2 |
|
甲/mol |
1.0 |
1.0 |
1.0 |
1.0 |
|
乙/mol |
1.0 |
1.5 |
1.0 |
1.0 |
①甲容器中H2O的平衡转化率为_______ (结果保留一位小数)。
②下列说法正确的是_______ (填编号)
A.若容器压强恒定,则反应达到平衡状态
B.若容器内气体密度恒定,则反应达到平衡状态
C.甲容器中H2O的平衡转化率大于乙容器中H2O的平衡转化率
D.增加Fe3O4就能提高H2O的转化率
(4)若将(3)中装置改为恒容绝热(不与外界交换能量)装置,按下表充入起始物质,起始时与平衡后的各物质的量见表:
|
|
Fe |
H2O(g) |
Fe3O4 |
H2 |
|
起始/mol |
3.0 |
4.0 |
0 |
0 |
|
平衡/mol |
m |
n |
p |
q |
若在达平衡后的装置中继续加入A、B、C三种状况下的各物质,见表:
|
|
Fe |
H2O(g) |
Fe3O4 |
H2 |
|
A/mol |
3.0 |
4.0 |
0 |
0 |
|
B/mol |
0 |
0 |
1 |
4 |
|
C/mol |
m |
n |
p |
q |
当上述可逆反应再一次达到平衡状态后,上述各装置中H2的百分含量按由大到小的顺序排列的关系是
________(用A、B、C表示)。
(5)已知Fe(OH)3的Ksp=2.79×10-39,而FeCl3溶液总是显示较强的酸性,若某FeCl3溶液的pH为3,则该溶液中c(Fe3+)=________mol • L-1 (结果保留3位有效数字)
|
一定条件下,将一定量的PCl5(g)通人密闭容器中,发生PCl5(g) | |
| [ ] | |
A. |
PCl3在平衡混合物中的体积分数约为33.3%[已知:M(PCl5)=208.5M(PCl3)=137.5] |
B. |
PCl5的转化率约为50% |
C. |
恒温恒容下往容器中再充入一定量的PCl5(g),再达到新平衡时,PCl3(g)的体积分数比原平衡时大 |
D. |
恒温恒压下往容器中再充人一定量的PCl5(g),再达到新平衡时,c(PCl5)∶c(PCl3)∶c(Cl2)约为1∶1∶1 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com