
题目列表(包括答案和解析)

图1-5
(1)Ti的原子序数为22,Ti位于元素周期表中第_________周期,第________族。
(2)步骤①加Fe的目的是:__________________________________________________;
步骤②冷却的目的是:_____________________________________________________。
(3)上述制备TiO2的过程中,可以利用的副产物是______________________;考虑成本和废物综合利用因素,废液中应加入_________处理。
(4)由金红石(TiO2)制取单质Ti,涉及的步骤为:
![]()
已知:①C(S)+O2(g)![]() CO2(g);ΔH=-393.5 kJ·mol-1
CO2(g);ΔH=-393.5 kJ·mol-1
②2CO(g)+O2(g)![]() 2CO2(g);ΔH=-566 kJ·mol-1
2CO2(g);ΔH=-566 kJ·mol-1
③TiO2(S)+2Cl2(g)![]() TiCl4(s)+O2(g);ΔH=+141 kJ·mol-1
TiCl4(s)+O2(g);ΔH=+141 kJ·mol-1
则TiO2(s)+2Cl2(g)+2C(s)![]() TiCl4(s)+2CO(g)的ΔH=______________。
TiCl4(s)+2CO(g)的ΔH=______________。
反应TiCl4+2Mg![]() 2MgCl2+Ti在Ar气氛中进行的理由是_______________________。
2MgCl2+Ti在Ar气氛中进行的理由是_______________________。
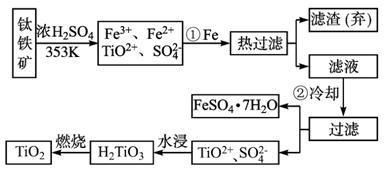
图2-3-3
(1)Ti的原子序数为22,Ti位于元素周期表中第_________周期,第_________族。
(2)步骤①加Fe的目的是:_____________________________________________;
步骤②冷却的目的是:________________________________________________。
(3)上述制备TiO2的过程中,可以利用的副产物是_________;考虑成本和废物综合利用因素,废液中应加入_________处理。
(4)由金红石(TiO2)制取单质Ti,涉及的步骤为:
![]()
已知:①C(s)+O2(g)====CO2(g); ΔH=-393.5 kJ·mol-1
②2CO(g)+O2(g)====2CO2(g); ΔH=-566 kJ·mol-1
③TiO2(s)+2Cl2(g)====TiCl4(s)+O2(g); ΔH=+141 kJ·mol-1
则TiO2(s)+2Cl2(g)+2C(s)====TiCl4(s)+2CO(g)的ΔH=_________。
反应TiCl4+2Mg====2MgCl2+Ti在Ar气氛中进行的理由是____________________________。

(1)Ti的原子序数为22,Ti位于元素周期表中第_________周期,第_________族。
(2)步骤①加Fe的目的是___________________________;
步骤②冷却的目的________________________________。
(3)上述制备TiO2的过程中,可以利用的副产物是_________,考虑成本和废物综合利用因素,废液中应加入_________处理。
(4)由金红石(TiO2)制取单质Ti,涉及到的步骤为:
TiO2![]() TiCl4
TiCl4![]() Ti
Ti
已知:①C(s)+O2(g)====CO2(g);ΔH=-393.5 kJ·mol-1
②2CO(g)+O2(g)====2CO2(g);ΔH=-566 kJ·mol-1
③TiO2(s)+2Cl2(g)====TiCl4(s)+O2(g);ΔH=+141 kJ·mol-1
则TiO2(s)+2Cl2(g)+2C(s)====TiCl4(s)+2CO(g)的ΔH=__________。
反应TiCl4+2Mg====2MgCl2+Ti在Ar气氛中进行的理由是____________________。
钛(Ti)被称为继铁、铝之后的第三金属,钛白(TiO2)是目前最好的白色颜料。制备TiO2、TiCl4和Ti的原料是钛铁矿,我国的钛铁矿储量居世界首位。用含有Fe2O3的钛铁矿(主要成分为FeTiO3)制取TiO2、TiCl4和Ti的流程如下:
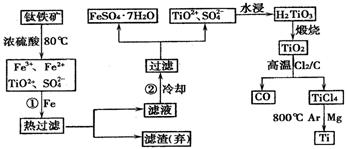
(1) Fe的原子序数为26,Fe位于元素周期表中第 周期,第 族
(2) 步骤①加铁粉的目的是
步骤②冷却的目的是
(3) 上述过程中,可以利用的副产物是
(4) 写出TiO2、Cl2、C在高温下发生反应的化学方程式
(5) 反应TiCl4+2Mg![]() 2MgCl2+Ti , 在Ar气体中进行的目的是
2MgCl2+Ti , 在Ar气体中进行的目的是
钛(Ti)被称为继铁、铝之后的第三金属。如下图所示,将钛厂、氯碱厂和甲醇厂组成产业链可以大大提高资源利用率,减少环境污染。请填写下列空白:
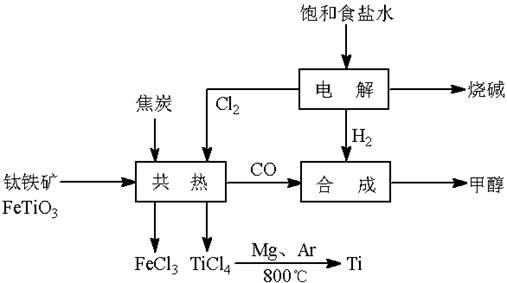
(1)电解饱和食盐水时,阳极的电极反应为 。
(2)写出钛铁矿与焦炭、Cl2共热制得四氯化钛的化学方程式________________________。
(3)已知:①Mg(s) + Cl2(g)=MgCl2(s);△H = – 641 kJ/mol
![]() ②Ti(s) + 2Cl2(g)=TiCl4(s);△H = –770 kJ/mol
②Ti(s) + 2Cl2(g)=TiCl4(s);△H = –770 kJ/mol
则2Mg(s) + TiCl4(s)=2MgCl2(s) + Ti(s);△H= 。
![]() 反应2Mg(s) + TiCl4(s)
反应2Mg(s) + TiCl4(s)![]() 2MgCl2(s) + Ti(s),在Ar气氛中进行的理由是 。
2MgCl2(s) + Ti(s),在Ar气氛中进行的理由是 。
(4)在上述产业链中,合成96 t 甲醇理论上消耗H2 t (不考虑生产过程中物质的任何损失)。
(5)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。已知该燃料电池的总反应式为:2CH3OH + 3O2 + 4OH-=2CO32- + 6H2O。该燃料电池发生反应时正极区溶液的pH (填“增大”、“减小”或“不变”),该电池中负极上的电极反应是________________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com