
题目列表(包括答案和解析)
 高锰酸钾(KMnO4)是实验室中常用制取氧气的物质.
高锰酸钾(KMnO4)是实验室中常用制取氧气的物质.
| ||
| ||

| 二氧化锰 |
| 加热 |
| 二氧化锰 |
| 加热 |
| 浓度 时间(min) 条件 |
30% H2O2 | 15% H2O2 | 5% H2O2 |
| 加入a g MnO2 | 0.2 | 0.8 | 2.0 |
| 加入a g Fe2O3 | 7.0 | 9.0 | 16.0 |
将过量的Na2CO3溶液滴入到一定量CuSO4溶液中得到蓝色固体。某研究性学习小组对固体沉淀的成分进行了如下探究。请完成下列各题:
(一)猜想与假设:
猜想一:固体为CuCO3,理由: (用化学反应方程式表示)。
猜想二:固体为Cu(OH)2,理由:Na2CO3溶液呈 (填“酸”或“碱”)性。
猜想三:固体为Cu(OH)2和CuCO3的混合物。
(二)资料查阅:
①结晶水合物受热后易失去结晶水,如CuSO4?5H2O CuSO4 + 5H2O↑;
CuSO4 + 5H2O↑;
②Cu(OH)2、CuCO3受热易分解,各生成对应的两种氧化物。
③无水氯化钙可做吸水剂;碱石灰的主要成分为氢氧化钠固体和氧化钙
(三)设计与实验:
Ⅰ.固体的获取:
(1)将反应后的固、液混合物经 、洗涤、室温晾干得蓝色固体。
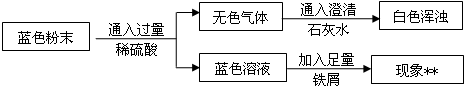
Ⅱ.用下图所示方案,初步定性探究固体的成分。 
(2)无色气体为
(3)加入足量铁屑发生反应的方程式为 、
结论:猜想 不成立。
Ⅲ.固体组成定量测定:
设固体为aCu(OH)2?bCuCO3?cH2O,为测定其组成,称取24.0 g蓝色固体。继续进行实验:
【实验步骤】
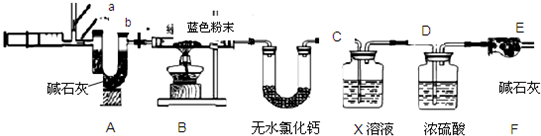
图中注射器处为两个单向阀:推注射器时a关闭,b处打开;拉注射器时,a打开进空气,b关闭。
实验步骤 ①组装好装置,检查气密性;②反复推拉注射器;③称量B、C、D、E、F的质量;④关闭弹簧夹,加热B处试管直到反应不再进行;⑤打开弹簧夹,再次反复缓缓推拉注射器;⑥再次称量B、C、D、E、F的质量。
问题探究:
(4)写出Cu(OH)2、CuCO3分解的化学方程式 、 。
样品分解的总反应方程式 。
说明装置B中样品没有完全反应的现象是
(5)D中的药品为 ,作用是 。
(6)进行步骤⑤的操作,是为了 ,该操作中推注射器时缓缓的目的是 。
数据处理:
| | B | C | D | E | F |
| 反应前 | 124.0g | 250.0g | 300.0g | 350.0g | 360.0g |
| 反应后 | 116.0g | 253.6g | 304.2g | 350.2g | 360.0g |
将过量的Na2CO3溶液滴入到一定量CuSO4溶液中得到蓝色固体。某研究性学习小组对固体沉淀的成分进行了如下探究。请完成下列各题:
(一)猜想与假设:
猜想一:固体为CuCO3,理由: (用化学反应方程式表示)。
猜想二:固体为Cu(OH)2,理由:Na2CO3溶液呈 (填“酸”或“碱”)性。
猜想三:固体为Cu(OH)2和CuCO3的混合物。
(二)资料查阅:
①结晶水合物受热后易失去结晶水,如CuSO4•5H2O CuSO4
+ 5H2O↑;
CuSO4
+ 5H2O↑;
②Cu(OH)2、CuCO3受热易分解,各生成对应的两种氧化物。
③无水氯化钙可做吸水剂;碱石灰的主要成分为氢氧化钠固体和氧化钙
(三)设计与实验:
Ⅰ.固体的获取:
(1)将反应后的固、液混合物经 、洗涤、室温晾干得蓝色固体。
Ⅱ.用下图所示方案,初步定性探究固体的成分。

(2)无色气体为
(3)加入足量铁屑发生反应的方程式为 、
结论:猜想 不成立。
Ⅲ.固体组成定量测定:
设固体为aCu(OH)2•bCuCO3•cH2O,为测定其组成,称取24.0 g蓝色固体。继续进行实验:
【实验步骤】

图中注射器处为两个单向阀:推注射器时a关闭,b处打开;拉注射器时,a打开进空气,b关闭。
实验步骤 ①组装好装置,检查气密性;②反复推拉注射器;③称量B、C、D、E、F的质量;④关闭弹簧夹,加热B处试管直到反应不再进行;⑤打开弹簧夹,再次反复缓缓推拉注射器;⑥再次称量B、C、D、E、F的质量。
问题探究:
(4)写出Cu(OH)2、CuCO3分解的化学方程式 、 。
样品分解的总反应方程式 。
说明装置B中样品没有完全反应的现象是
(5)D中的药品为 ,作用是 。
(6)进行步骤⑤的操作,是为了 ,该操作中推注射器时缓缓的目的是 。
数据处理:
|
|
B |
C |
D |
E |
F |
|
反应前 |
124.0g |
250.0g |
300.0g |
350.0g |
360.0g |
|
反应后 |
116.0g |
253.6g |
304.2g |
350.2g |
360.0g |
(7)据下表数据,E装置质量增加的原因是 ;24.0g固体分解出水的质量为 g,;
(8)求该固体的化学式中 a:b:c= 。(写出计算过程,4分)
| ||
| ||
| ||
| ||
| ||
| ||
| ||
| B | C | D | E | F | |
| 反应前 | 124.0g | 250.0g | 300.0g | 350.0g | 360.0g |
| 反应后 | 116.0g | 253.6g | 304.2g | 350.2g | 360.0g |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com