
题目列表(包括答案和解析)
氨水是一种的常用的化学试剂。
(1)以浓氨水和生石灰为原料,用如下装置为发生装置,可制取少 量氨气。已知:NH3·H2O+CaO=Ca(OH)2+NH3↑。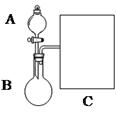
①生石灰应该装在 (填A或B)。
②试从电离平衡角度分析该实验中氨气逸出的原因: 。
③现要用试管和必要实验用品收集一试管氨气,请在C处补充相应收集装置。
(2)化学兴趣小组用氨水与硝酸银溶液配制好银氨溶液后,进行乙醛的银镜反应实验,但部分同学实验时间长,且效果不明显。影响乙醛银镜反应速率的因素有哪些呢?请你完成如下猜想:
①猜想:因素一:银氨溶液的pH大小;
因素二: 。
②你设计实验验证上述影响因素一,完成下表中内容。
提供试剂:乙醛、2%稀氨水、 0.25mol/L NaOH溶液、盐酸 、 2% AgNO3溶液
实验用品:烧杯(装有热水)、试管
| 实验步骤 | 实验操作 | 预期现象及结论(步骤1只填现象) |
| 1 | 在A、B两支洁净的试管中各入1mL 2%的AgNO3溶液,然后边振荡试管边逐滴滴入2%稀氨水,至最初产生的沉淀恰好完全溶解,此时制得pH均约为8的银氨溶液。 | |
| 2 | | |
| 实验步骤 | 实验操作 | 预期现象及结论(步骤1只填现象) |
| 1 | 在A、B两支洁净的试管中各入1mL 2%的AgNO3溶液,然后边振荡试管边逐滴滴入2%稀氨水,至最初产生的沉淀恰好完全溶解,此时制得pH均约为8的银氨溶液。 | |
| 2 | | |
某探究小组用KMnO4酸性溶液与H2C2O4溶液反应过程中溶液紫色消失快慢的方法,研究影响反应速率的因素。实验条件作如下限定:所用酸性KMnO4溶液的浓度可选择0.010 mol?L-1、0.0010 mol?L-1, 催化剂的用量可选择0.5 g、0 g,实验温度可选择298 K、323 K。每次实验KMnO4酸性溶液的用量均为4 mL、H2C2O4溶液(0.10 mol?L-1)的用量均为2 mL。
⑴请完成以下实验设计表:完成④的实验条件,并将实验目的补充完整。 
⑵该反应的催化剂选择MnCl2还是MnSO4 ,简述选择的理由
⑶某同学对实验①和②分别进行了三次实验,测得以下实验数据(从混合振荡均匀开始计时): 
a、实验②中用KMnO4的浓度变化来表示的平均反应速率为 (忽略混合前后溶液的体积变化)。
b、该同学分析上述数据后得出“当其他条件相同的情况下,酸性KMnO4溶液的浓度越小,所需要的时间就越短,亦即其反应速率越快”的结论,你认为是否正确 (填“是”或“否”)。他认为不用经过计算,直接根据表中褪色时间的长短就可以判断浓度大小与反应速率的关系,你认为是否可行
(填“是”或“否”)。
I.某校化学实验小组探究浓度对化学反应速率的影响,并测定![]() 和KI反应的化学反应速率。进行如下实验探究:
和KI反应的化学反应速率。进行如下实验探究:
【实验原理】
![]() 和KI反应的离子方程式为:
和KI反应的离子方程式为:
![]() (1)
(1)
平均反应速率的计算式为![]() 。
。
实验时,向![]() 、
、![]() 和淀粉指示剂混合溶液中加入
和淀粉指示剂混合溶液中加入![]() 溶液,不断搅拌。
溶液,不断搅拌。
在反应(1)进行的同时,发生反应:
![]() (2)
(2)
反应(1)生成的![]() 立即与
立即与![]() 反应,生成无色的
反应,生成无色的![]() 和
和![]() 。
。![]() 耗尽时,反应(1)继续生成的
耗尽时,反应(1)继续生成的![]() 才与淀粉作用呈现蓝色。从加入
才与淀粉作用呈现蓝色。从加入![]() 溶液到出现蓝色的时间为
溶液到出现蓝色的时间为![]() 。
。
【实验内容】
(1)实验小组设计的实验记录表和数据记录如下,请将表中字母表示的空格填上。
| 实验编号 | ① | ② | ③ | ④ | ⑤ | |
| 试剂 用量 (mL) | 0.20 mol·L | 20.0 | 10.0 | b | 20.0 | 20.0 |
| 0.20 mol·L | 20.0 | 20.0 | 20.0 | 10.0 | 5.0 | |
| 0.010 mol·L | a | 8.0 | 8.0 | 8.0 | 8.0 | |
| 0.2%淀粉溶液 | 2.0 | 2.0 | 2.0 | 2.0 | 2.0 | |
| 0.20 mol·L | 0 | 0 | 0 | 10.0 | c | |
| 0.20 mol·L | 0 | 10.0 | 15.0 | 0 | 0 | |
| 20℃时,反应时间 | 32 | 67 | 130 | 66 | 135 | |
| 为了使溶液的离子强度和总体积保持不变,减少的(NH4)2S2O8溶液或KI溶液的用量,分别用(NH4)2SO4溶液或KNO3溶液补足;溶液混合后体积不变 | ||||||
(2)为了使反应充分进行,减少数据误差,实验过程中应该不断进行的操作是 。
(3)第①组实验的![]() mol·(L·s)
mol·(L·s)![]() 。
。
(4)根据上表数据分析,可以得到的结论有(写出一条即可) 。
II.实验小组查资料得知,向含有NaCO3的Na2S溶液中通入SO2,可以制备上述实验所需的Na2S2O3。反应如下:
![]()
![]()
![]()
该小组根据上述原理设计如图19所示装置制备![]() 。
。

(1)实验应避免有害气体排放到空气中。装置①、②中盛放的试剂依次是① ;② 。
(2)实验过程中,随着气体的通入,装置①中有大量黄色固体析出,继续通入气体,可以观察到的现象是 。
(3)反应结束后,从制得的![]() 稀溶液中得到
稀溶液中得到![]() 晶体的主要操作包括: 。
晶体的主要操作包括: 。
CO2的固定和利用在降低温室气体排放中具有重要作用,从CO2加氢合成甲醇不仅可以有效缓解减排压力,还是其综合利用的一条新途径。CO2和H2在催化剂作用下能发生反应CO2+3H2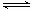 CH3OH+H2O,测得甲醇的理论产率与反应温度、压强的关系如图所示。请回答下列问题:
CH3OH+H2O,测得甲醇的理论产率与反应温度、压强的关系如图所示。请回答下列问题:
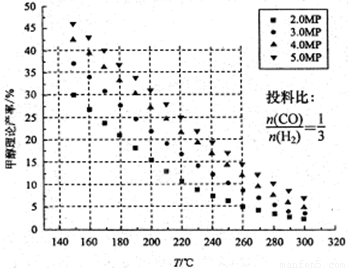
(1)提高甲醇产率的措施是 。
(2)分析图中数据可知,在220 ℃、5MPa时,CO2的转化率为 ,再将温度降低至
140℃,压强减小至2MPa,化学反应速率将 (填“增大、减小 或 不变“ 下同),CO2的转化率将 。
(3)200℃时,将0.100molCO2和0.275molH2充入1L密闭容器中,在催化剂作用下反应达到平衡。若CO2的转化率为25%,则此温度下该反应的平衡常数K= 。(要求写出算式和计算结果)
(4)已知已知:CO的燃烧热△H=-283.0KJ/mol、2H2(g)+O2(g)=2H2O(g) △H=-483.6KJ/mol、
CO(g)+2H2(g)=CH3OH(g) △H=-90.1KJ/mol,写出CO2与H2合成甲醇的热化学方程式 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com